
分析 (1)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,加相同的离子电离平衡逆向移动;
(2)①酸性强弱顺序是H2SO3>H2CO3>HSO3->HCO3-,强酸能和弱酸盐反应生成弱酸,据此分析解答;
②酸性:H2CO3>HClO>HCO3-,强酸能和弱酸盐反应生成弱酸;
(3)根据平衡常数K=$\frac{c(HC{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$计算;
(4)酸抑制水的电离,氢离子浓度越大,水的电离程度越小;氢离子浓度越小,反应速率越慢;
(5)温度不变,饱和氢氧化钠的浓度不变.
解答 解:(1)a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则电离平衡向左移动,故a正确;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,电离平衡向右移动,故b错误;
c.加入醋酸钠,溶液中醋酸根离子浓度增大,电离平衡向左移动,故c正确;
d.加少量的冰醋酸,电离平衡向右移动,故d错误;
故答案为:ac;
(2)①电离常数越大,酸性越强,由电离常数可知,酸性强弱顺序是H2SO3>H2CO3>HSO3->HCO3-,强酸能和弱酸盐反应生成弱酸,所以HSO3-、CO32-能相互反应而不能共存;
故答案为:B;
②酸性:H2CO3>HClO>HCO3-,强酸能和弱酸盐反应生成弱酸,则将少量CO2通入到NaClO溶液中发生反应的离子方程式为ClO-+H2O+CO2=HClO+HCO3-;
故答案为:ClO-+H2O+CO2=HClO+HCO3-;
(3)根据平衡常数K=$\frac{c(HC{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=4.2×10-7,
故答案为:4.2×10-7;
(4)酸抑制水的电离,氢离子浓度越大,水的电离程度越小,Zn和稀硫酸制取H2,氢离子浓度减小,水的电离程度增大;氢离子浓度越小,反应速率越慢,加醋酸钠生成醋酸,溶液中酸的总浓度不变,但是氢离子浓度减小,所以产生H2的总量不变而速率减小;
故答案为:增大:c;
(5)温度不变,饱和氢氧化钠的浓度不变,所以电解饱和氢氧化钠溶液时,水的量减小,会析出氢氧化钠,氢氧化钠的浓度不变,所以水的电离平衡不移动;
故答案为:不.
点评 本题考查电解质的电离、电离平衡的移动以及电离常数的计算,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | +4→+3 | B. | +2→+3 | C. | 0→+2 | D. | -4→-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤④①② | B. | ③④②①⑤ | C. | ④①②⑤③ | D. | ③②④①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
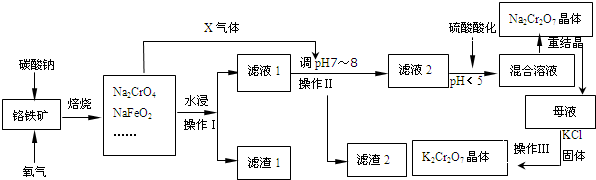
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
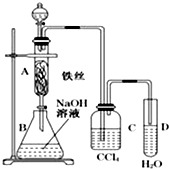 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com