
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
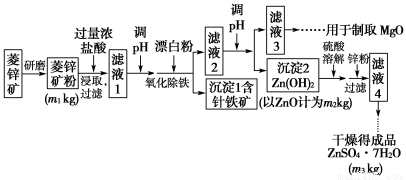
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______=□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉 淀的pH | 10.4 | 6.4 |
|
|
沉淀完全 的pH | 12.4 | 8.0 |
|
|
开始溶 解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
(1) 增大反应物接触面积或增加反应时的接触面积,使反应更加充分
(2) 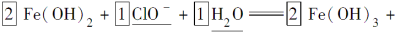
(3)FeO(OH)(或其他合理答案)
(4)8.0≤pH≤10.4(或其他合理答案)
(5)b或(b和d)或d
(6)蒸发浓缩、冷却结晶(或其他合理答案)
(7)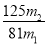 (或其他合理答案)
(或其他合理答案)
【解析】(1) 将菱铁矿研磨成粉可以增加反应时的接触面积,使得反应更加充分。
(2)漂白粉的成分中含有次氯酸根,调节酸碱度后,具有较强的氧化性,能使+2价的亚铁离子氧化成+3价,氢氧化亚铁变成氢氧化铁必须增加氢氧元素的量,可以推测出另一种反应物为水,清楚了反应物,一般可以顺利的配平。
(3) 化学式量为89,组成元素是Fe、O、H,其中铁的相对原子质量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH)。
(4)pH=8.0 Zn(OH)2完全沉淀,pH=10.5开始溶解,而Mg(OH)2在pH=10.4的时候开始沉淀,为了使Zn(OH)2能完全析出不影响Mg(OH)2,溶液的酸碱度控制在8.0≤pH≤10.4范围。
(5)a大理石粉难溶于水,选择熟石灰和烧碱溶液可以使溶液的碱性增强,有利于镁离子完全沉淀。
(6)蒸发浓缩、冷却结晶能使晶体尽快的析出。
(7)综合计算(不展开)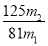


科目:高中化学 来源:2014年高考化学指导冲关 第11练化学实验基础知识练习卷(解析版) 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
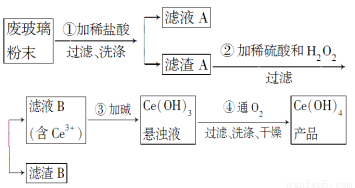
(1)洗涤滤渣A的目的是为了去除________(填离子符号),检验该离子是否洗净的方法是___________________________________________________。
(2)第②步反应的离子方程式是__________________________________,滤渣B的主要成分是________。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点(铈被还原为Ce3+),消耗25.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:选择题
下列反应的离子方程式表示正确的是( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C.小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
D.将足量的铁丝投入稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:填空题
氨气既是一种工业产品,也是一种重要的工业原料。在工农业生产中具有广泛的用途。
(1)工业合成氨是在________(填工业设备名称)中完成的,某合成氨工厂一天中通入的N2为20 t,通入的H2为3 t,那么这一天生产的NH3可能为________t。
a.23 b.24.3 c.17 d.6
(2)合成氨的原料气氮气来自大气,工业上从空气中分离出氮气的方法有物理方法和化学方法。物理方法是________,化学方法是___________________。
(3)合成氨的原料气氢气主要来自煤的气化,气化过程中除得到氢气外,还得到另外一种燃料气,这种燃料气的化学式为________。
(4)我国化学家侯德榜改革国外的纯碱生产工艺,发明了“侯氏制碱法”。该法制碱是向饱和食盐水中通入NH3和CO2,在实际工业生产中,这两种气体的通入顺序是________,“侯氏制碱法”的副产品可作农业生产的化肥,该副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:选择题
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.所有元素原子的最外层电子数都等于元素的最高化合价
B.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
C.多电子原子中,在离核较近的区域内运动的电子能量较高
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
某酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
阿伏加德罗常数为NA,下列说法中正确的是( )
A.62 g Na2O溶于水后所得溶液中含有的O2-数为NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA
C.常温常压下,16 g甲基(—13CH3)所含的中子数为10NA
D.0.5 mol Cu和足量浓硝酸反应可以生成22.4 L NO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:填空题
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
A.升高温度
B.加入高效催化剂
C.将XQ3及时分离出去
D.增大反应体系压强
E.增大反应物浓度
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com