
有关晶体(晶胞)的结构如下图所示,下列说法不正确的是( )

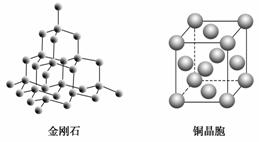
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶4
D.铜晶体为面心立方堆积,铜原子的配位数为12
科目:高中化学 来源: 题型:
A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原
子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融
时能导电。试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)用电子式表示A、B元素形成化合物的过程:_____________________________
________________________________________________________________________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了
________个阴离子;晶体中阴、阳离子数之比为__________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的性质叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列晶体中,前者属于原子晶体,后者属于分子晶体的是( )
A.硅晶体、二氧化硅晶体
B.足球烯(C60)、天然气水合物
C.金刚石、冰
D.干冰、碳化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
据某科学杂志报道,国外有一研究机构发现了一种新的球形分子,它的分子式为C60Si60,其分子结构酷似中国传统工艺“镂雕”,经测定其中包含C60,并且也有Si60结构,下列叙述不正确的是( )
A.该物质有很高的熔点,很大的硬度
B.该物质形成的晶体属于分子晶体
C.该物质分子中C60被包裹在Si60里面
D.该物质的相对分子质量为2 400
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氮化钠(Na3N)在熔融时能导电,与水作用时有NH3产生。试回答下列问题:
(1)Na3N中存在的离子为____________,Na3N属于________化合物。
(2)比较微粒的半径Na+________N3-(填“<”、“>”或“=”)。
(3)Na3N与水作用时的化学反应方程式是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com