
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:
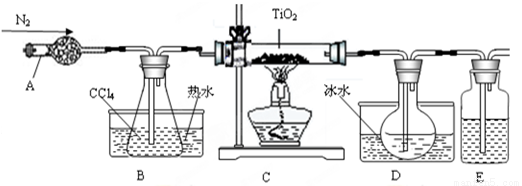
有关性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
(1)干燥管;浓硫酸;检查气密性;②③①,分液(或蒸馏)
(2)①Fe 温度过高会导致TiSO4提前水解,产生H2SiO3沉淀
②Fe2+,Fe2O3
【解析】(1)仪器A是干燥管,由于IiCl4遇到水蒸气会水解,所以E中用浓硫酸吸收空气中水蒸气。对于气体制取而言,组装仪器、检查气密性、加药品,终止实验时防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2。分离两种沸点不同的液体混合物应该用蒸馏法。
(2)①矿石经硫酸溶解后得到的Fe2(SO4)3,而后过滤得到的是FeSO4·7H2O,所以试剂A是铁粉,把Fe3+还原为Fe2+。因为TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3,而经过滤进入FeSO4·7H2O中导致TiO2产率降低。
②加入KSCN溶液无现象,加H2O2出现红色,说明存在Fe2+,经过加热后Fe2+氧化为Fe2O3,而使产品发黄。


科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是。
选项 | 实验事实 | 结论 |
A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化性 |
D | 将SO2通入溴水中,酸性高锰酸钾溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
稀氨水中存在着下列平衡:NH3·H2O NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
用下图所示装置(必要时可加热试管),不能完成的实验是

A.试管中盛酚酞溶液,验证氨气的水溶液呈碱性
B.试管中盛酸性高锰酸钾溶液,探究SO2的还原性
C.试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物
D.试管中盛淀粉KI溶液,验证氯气的氧化性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
在实验室中进行下列实验探究,其中的实验用品均能用到且正确的是
选项 | 实验探究内容 | 实验用品 |
A | 铜丝在氯气中燃烧 | 坩埚钳、燃烧匙、氯气、铜丝 |
B | 铝热反应 | 铁架台、大蒸发皿、普通漏斗、铝粉、Fe2O3 |
C | 实验室制备氨气 | 试管、集气瓶、酒精灯、NH4Cl、Ca(OH)2 |
D | 用KMnO4晶体配制500mL0.1mol·L-1KMnO4溶液 | 容量瓶、烧杯、玻璃棒、酸式滴定管、KMnO4 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定,放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
用pH试纸测定某无色溶液的pH时,规范的操作是
A.将pH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
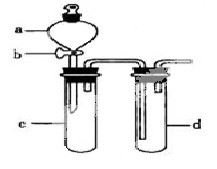
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池。电池总反应为V2O4+xLi LixV2O4下列说法正确的是
LixV2O4下列说法正确的是
A.该电池充电时锂极与外电源的负极相连
B.电池在放电时,Li+向负极移动
C.该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D.若放电时转移0.2 mol电子,则用去的锂为1.4x g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com