
| Fe3+ | Cu2+ | Cr3+ | |
| ��ʼ����pH | 2.1 | 4.7 | 4.3 |
| ��ȫ����pH | 3.2 | 6.7 | a |
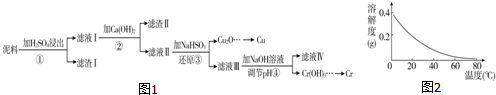
���� �������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������ Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4���ݴ˷������
��� �⣺�������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4��
��1��ͨ�����Ϸ���֪����ҺI�����ʳɷ�ΪFe2��SO4��3��Cr2��SO4��3��CuSO4��
�ʴ�Ϊ��Fe2��SO4��3��Cr2��SO4��3��CuSO4��
��2��Fe3+��ȫ������Ҫ��pH��3.2��pH=4.3ʱCr3+��ʼ����������Ҫʹ��������ȫ�������������Ӳ���������pH��ΧΪ��3.2��pH��4.3��ͨ�����Ϸ���֪������II�ɷ�ΪFe��OH��3��CaSO4��
�ʴ�Ϊ��3.2��pH��4.3�� Fe��OH��3��CaSO4��
��3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O��
�ʴ�Ϊ��2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O��
��4��������Ũ�ȡ�1��10-5mol•L-1ʱ��������Ϊ���ӳ�����ȫ����ҪʹCr3+��ȫ��������c��Cr3+����1��10-5mol•L-1��c��OH-��=$\root{3}{\frac{Ksp}{c��Cr{\;}^{3+}��}}$=$\root{3}{\frac{6.3��10{\;}^{-31}}{10{\;}^{-5}}}$mol/L=4.0��10-9 mol/L��c��H+��=$\frac{10{\;}^{-14}}{4.0��10{\;}^{-9}}$=2.5��10-6mol/L������Һ��pH=-lg2.5��10-6=5.6��
�ʴ�Ϊ��5.6��
��5��Cr2O3��Al�����·������ȷ�Ӧ������������Cr����Ӧ����ʽΪCr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr���ʴ�Ϊ��Cr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr��
���� ���⿼�����ʵķ�����ᴿ�ۺ�Ӧ�ã�Ϊ�߿���Ƶ�㣬�漰��������ܽ�ƽ�⡢����ұ��������ʵ�������֪ʶ�㣬���ؿ�����������㼰ʵ�������������Ϥ����ͼ���漰�ķ�Ӧ�������������ѵ����ܶȻ��������㣮


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | �� �� | �� �� | �� �� |
| A | ����ҺX�еμ�NaOHŨ��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ���� | ��ҺX����NH4+ |
| B | �������������ƹ���Ͷ����ɫʯ����Һ�� | ��Һ��ɺ�ɫ | ����������ˮ��Ӧ�����������ƣ���Һ�ʼ��� |
| C | ��ˮ����ͨ�����ȵ����� | ��ĩ��� | ����ˮ�ڸ����·�����Ӧ |
| D | �����£���ͭ����Ũ������ | �����Ա仯 | ͭ�����Ũ�����жۻ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �Ҷ����׳Ʋ�����һ�ֶ�Ԫ���ᣨ�ṹ��ʽΪHOOC-COOH���ɼ�дΪH2C2O4��������һ����Ҫ�Ļ���ԭ�ϣ���������0.01mol/L��H2C2O4��KHC2O4��K2C2O4��Һ��pH�����ʾ����գ�
�Ҷ����׳Ʋ�����һ�ֶ�Ԫ���ᣨ�ṹ��ʽΪHOOC-COOH���ɼ�дΪH2C2O4��������һ����Ҫ�Ļ���ԭ�ϣ���������0.01mol/L��H2C2O4��KHC2O4��K2C2O4��Һ��pH�����ʾ����գ�| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
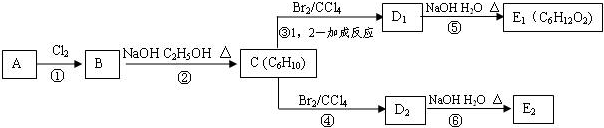
 ��E2���еĺ��������ŵ�����Ϊ���ǻ���
��E2���еĺ��������ŵ�����Ϊ���ǻ���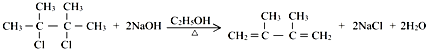 ����Ӧ����Ϊ����ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
����Ӧ����Ϊ����ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��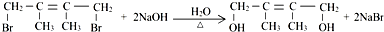 ����Ӧ����Ϊ��ˮ�ⷴӦ����ȡ����Ӧ����
����Ӧ����Ϊ��ˮ�ⷴӦ����ȡ����Ӧ����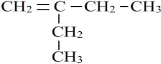 ��
��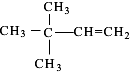 ���������������칹����
���������������칹�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
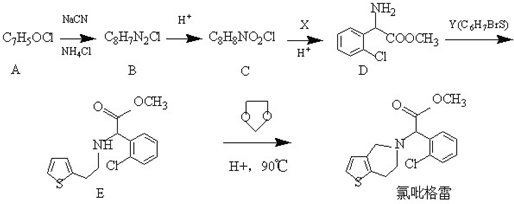
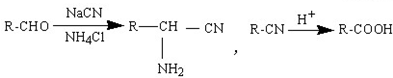
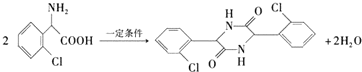 ��
��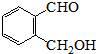 Ϊ�л�ԭ���Ʊ�������ĺϳ�·������ͼ
Ϊ�л�ԭ���Ʊ�������ĺϳ�·������ͼ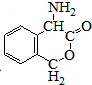 �����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�����Լ���ѡ�����ϳ�·������ͼʾ�����£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al3+��K+��SO42-��Cl-��Al[��OH��4]- | B�� | Al3+��Na+��Cl-��SO42-��NO3- | ||
| C�� | Na+��K+��SO42-��NO3-��Cl- | D�� | Fe2+��H+��Br-��NO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ���壬������ˮ���ܶȱȿ�����С | |
| B�� | ��ϩȼ��ʱ������������ͬʱ�������� | |
| C�� | ����ˮ����ȡ����Ӧ��ʹ��ˮ��ɫ | |
| D�� | ��ϩ�IJ�����־��һ�����ҵ�ʯ�ͻ���ˮƽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com