
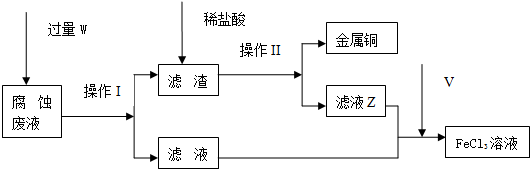
分析 从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用,则废液中加过量W(Fe粉),滤液为FeCl2,滤渣为Fe和Cu,滤渣中加过量盐酸,因Cu与盐酸不反应,则所得滤液为FeCl2,将滤液氯化亚铁中通入氯气可反应得到FeCl3溶液,然后结合实验过程及化学用语来解答,
(1)FeCl3溶液与铜反应生产氯化亚铁和氯化铜;
(2)其废液中有大量CuCl2、FeCl2和FeCl3,加入过量W为铁粉反应生成铜、亚铁离子,分离固体和溶液用过滤,据此选择玻璃仪器;
(3)①用10mol•L-1 的浓盐酸配制250mL 1mol•L-1 的稀盐酸,稀释前后溶质的物质的量不变,计算得到溶液体积;
②配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(4)滤液Y和滤液Z合并后通入足量气体V为氯气氧化氯化亚铁生成氯化铁,实验室制取气体V为氯气,利用二氧化锰和浓盐酸加热反应生成;
(5)通入氯气的目的是氧化Fe2+,如果氯气量不足,会有少量Fe2+未氧化,故只要通过证明溶液里是否含有Fe2+来证明氯气的量是否不足,可滴加酸性KMnO4溶液看是否褪色来判断;
解答 解:(1)FeCl3溶液与铜反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)金属铁可以讲金属铜从其盐中置换出来,所以加的W是铁粉或Fe,操作 I的名称是过滤,该操作中用到的玻璃仪器有漏斗、玻璃棒、烧杯,
故答案为:铁粉或Fe;漏斗、玻璃棒、烧杯;
(3)①用10mol•L-1 的浓盐酸配制250mL 1mol•L-1 的稀盐酸,稀释前后溶质的物质的量不变,这所需浓盐酸的体积是V,则V•10mol•L-1=250mL•1mol•L-1,解得V=25mL,故答案为:25mL;
②配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(4)滤液Y和滤液Z合并后通入足量气体V为氯气氧化氯化亚铁生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,实验室制氯气的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:2Fe2++Cl2=2Fe3++2Cl-,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)若通入的氯气的量不足,亚铁离子不会完全被氧化为三价铁离子,所以最后制得的氯化铁晶体不纯净,会含有氯化亚铁,亚铁离子具有还原性,可以是高锰酸钾褪色,三价铁离子能使硫氰酸钾变为红色,可以据此来检验,
故答案为:FeCl2或Fe2+;取少量溶液,加入几滴KSCN溶液,溶液显红色,则表明溶液中有Fe3+(FeCl3);另取少量溶液,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液中有Fe2+(或FeCl2),说明通入的氯气的量不足够,若KMnO4溶液不退色,则说明通入的氯气的量充足;
点评 本题以实验的形式考查混合物的分离、提纯,注意发生的化学反应及元素守恒的角度来分析是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则X中含有SO42- | |
| B. | 向饱和FeCl3溶液中滴加少量氨水,可制取Fe(OH)3胶体 | |
| C. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用KSCN溶液 | |
| D. | 向1mL l% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL 5%葡萄糖溶液,加热,未出现红色沉淀,证明葡萄糖中不含醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com