
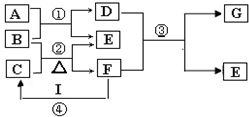
分析 本题的突破口为:在实验室中,常用固体B和固体C加热制取气体F,应为NH4Cl和Ca(OH)2反应生成氨气的反应,则F为NH3,E为CaCl2,根据F可与I生成C,则C为NH4Cl,B为Ca(OH)2,I为HCl,根据F与G的组成元素相同,G与I(为HCl,含有18个电子)分子所含电子数相同来判断,G为N2H4,由题中(3)向具有漂白作用的D溶液,可知D为Ca(ClO)2,则A为Cl2,以此来回答题中各问题.
解答 解:在实验室中,常用固体B和固体C加热制取气体F,应为NH4Cl和Ca(OH)2反应生成氨气的反应,则F为NH3,E为CaCl2,根据F可与I生成C,则C为NH4Cl,B为Ca(OH)2,I为HCl,根据F与G的组成元素相同,G与I(为HCl,含有18个电子)分子所含电子数相同来判断,G为N2H4,由题中(3)向具有漂白作用的D溶液,可知D为Ca(ClO)2,则A为Cl2,
(1)根据上面的分析可知,B为Ca(OH)2,I为HCl,
故答案为:Ca(OH)2;HCl;
(2)反应④为:NH3+HCl═NH4Cl,有白烟生成,NH3工业上可用于制硝酸或氮肥,
故答案为:白烟生成;NH3工业上可用于制硝酸或氮肥;
(3)向具有漂白作用的D溶液加入I的浓溶液有A生成,其反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(4)反应③的化学方程式为4NH3+Ca(ClO)2=2N2H4+CaCl2+2H2O,
故答案为:4NH3+Ca(ClO)2=2N2H4+CaCl2+2H2O.
点评 本题考查元素化合物的推断,做题注意抓住题目中的组成、结构、性质等关键信心作为做题的突破口,本题较为综合,具有一定难度,注意元素化合物基础知识的积累.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.85 g | B. | 11.7 g | C. | 8 g | D. | 15.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
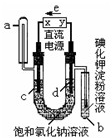 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )| A. | 在电解开始时,a管中有无色气体生成 | |
| B. | x极为阴性 | |
| C. | 在电解开始后,在c极附近颜色变红 | |
| D. | 通电一段时间后,混合液颜色可能变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>C | B. | 原子序数C>B>A | ||
| C. | 单质的还原性A>B>C | D. | 离子半径C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com