短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z W(填“>”、“<”或“=”,后同);电负性:X Y.
(2)写出Q的价电子排布图 ,YF3的结构式 .
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化: .
【答案】
分析:短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Z、W是常见金属,原子序数大于碳元素,常用第三周期,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,则W为Al元素、Z为Mg元素;Y的氟化物YF
3分子中各原子均达到8电子稳定结构,Y为非金属性,则Y表现+3价,最外层电子数为8-3=5,处于ⅤA族,原子序数小于Mg元素,则Y为氮元素;Q处于第三周期,p能级上有一个未成对电子,外围电子排布为3s
23p
1或3s
23p
5,由于W为Al元素,则Q为Cl元素,据此解答.
解答:解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Z、W是常见金属,原子序数大于碳元素,常用第三周期,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,则W为Al元素、Z为Mg元素;Y的氟化物YF
3分子中各原子均达到8电子稳定结构,Y为非金属性,则Y表现+3价,最外层电子数为8-3=5,处于ⅤA族,原子序数小于Mg元素,则Y为氮元素;Q处于第三周期,p能级上有一个未成对电子,外围电子排布为3s
23p
1或3s
23p
5,由于W为Al元素,则Q为Cl元素,
(1)Mg原子2s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能比Al元素的高;
同周期自左而右电负性增大,故电负性C<N,
故答案为:>;<;
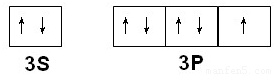
(2)Q为Cl元素,外围电子排布为3s
23p
5,价电子排布图为
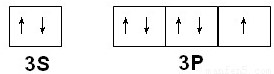
,NF
3中氮原子越氟原子之间形成1对共用电子对,结构式为:
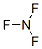
,
故答案为:
;

;
(3)向硫酸铜溶液中逐滴滴入氨水溶液至过量,先生成氢氧化铜与硫酸铵,有蓝色沉淀生成,继续滴加过量的氨水,氢氧化铜与氨水反应生成四氨合铜络离子,蓝色沉淀消失,溶液呈深蓝色,反应离子方程式为:Cu
2++2NH
3?H
2O=Cu(OH)
2↓+2NH
4+;或Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O,
故答案为:Cu
2++2NH
3?H
2O=Cu(OH)
2↓+2NH
4+;或Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O.
点评:本题考查结构性质位置关系、元素周期律、核外电子排布、络合物等,难度中等,推断元素是解题的关键,注意(3)中络离子的生成.

 ,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为:
,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为: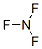 ,
, ;
; ;
;

 短周期主族元素X、Y、Z、W、M在元素周期表中的位置如图,W最高价氧化物对应的水化物为强酸,下列说法正确的是( )
短周期主族元素X、Y、Z、W、M在元素周期表中的位置如图,W最高价氧化物对应的水化物为强酸,下列说法正确的是( )