
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.分析 (1)(2)甲醇燃料电池中负极上甲醇失电子和水反应生成二氧化碳、氢离子,正极上氧气得电子和氢离子反应生成水,在得失电子相等的条件下正、负极电极反应式相加即得电池总反应式;
(3)原电池放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,电子从负极沿导线流向正极;
解答 解:(1)(2)甲醇燃料电池实质就是利用CH3OH燃料在氧气中反应来提供电能,CH3OH作负极,发生氧化反应,电极反应为:2CH3OH+2H2O-12e-=2CO2↑+12H+;氧气在正极反应:3O2+12H++12e--=6H2O,两反应相加得总反应式,所以电池总反应式为:2CH3OH+3O2═2CO2+4H2O;
故答案为:(1)2CH3OH+3O2═2CO2+4H2O;
(2)CH4O+H2O-6e-=CO2+6H+;
(3)在电池中,负极释放电子传到正极上,故H+向正极移动,释放电子的电极是负极;
故答案为:正;负极;
点评 本题考查了燃料电池,根据正负极上发生的反应、电子移动方向、离子移动方向等知识点来分析解答,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y>W>Z | B. | 离子半径:X<Y | ||
| C. | 气态氢化物的稳定性:W>Y | D. | W与X可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统命名是2,3-二甲基-1,3-戊二烯.
的系统命名是2,3-二甲基-1,3-戊二烯.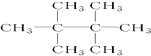 .
. .
.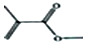 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
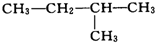
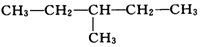
| A. | ①②和④ | B. | ②③和⑤ | C. | ①和② | D. | ④和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇均能被酸性高锰酸钾溶液氧化 | |
| B. | 甲烷和苯均可在光照的条件下与氯气发生取代反应 | |
| C. | 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应 | |
| D. | 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有吸水性 | |
| B. | 盐酸有挥发性 | |
| C. | 气态溶质的溶解度随温度开高而降低 | |
| D. | 浓硫酸有脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com