
| A. | 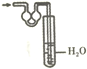 | B. |  | C. | 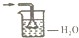 | D. | 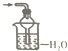 |
分析 氨气极易溶于水,吸收氨气时不能直接将导管插入水中,必须使用防止倒吸的装置;常用的方法为:使用倒置的漏斗、使用球形漏斗、使用四氯化碳和水的混合液,据此进行判断.
解答 解:A.吸收装置中的导管外联双球状导管内伸入到液体中,能防止倒吸,故A正确;
B.氨气不溶于四氯化碳,该装置可以防止倒吸,可用于吸收氨气,故B正确;
C.氨气极易溶于水,将漏斗插入水中过深,易发生倒吸,故C错误;
D.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故D错正确.
故选C.
点评 本题考查了常见气体的尾气吸收,题目难度不大,注意明确常见的极易溶于水的气体在尾气吸收时,必须使用防止倒吸的装置,要求学生能够正确判断装置是否具有防止倒吸的作用.


科目:高中化学 来源: 题型:选择题
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
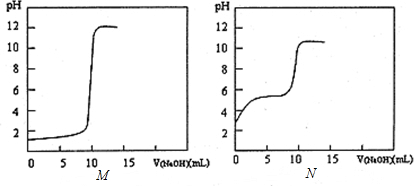
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
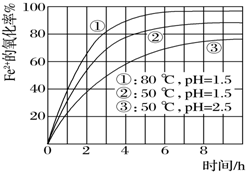 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
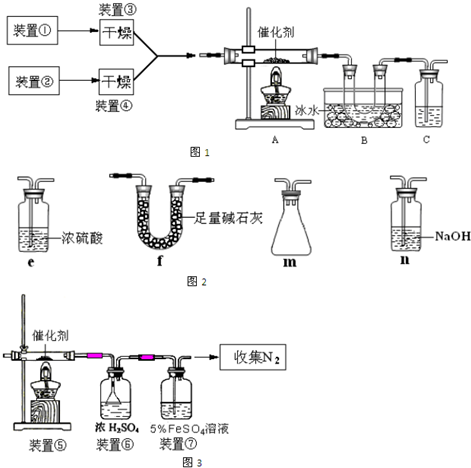
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 试剂 | 现象 |
| ①淀粉 ②苯乙烯 ③苯酚 ④蛋白质 | a.浓硝酸 b.酸性高锰酸钾溶液 c.碘水 d.FeCl3溶液 | A.呈紫色 B.呈蓝色 C.紫色褪去 D.呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①的主要反应为:Cl2+2Br-→Br2+2Cl- | |
| B. | 物质X为HBrO | |
| C. | 步骤②③的目的是富集溴元素 | |
| D. | 步骤②利用了溴易挥发的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com