
【题目】亚硝酸钠(NaNO2)是一种常用的食品添加剂,使用时需严格控制用量。实验室以2NO+Na2O2=2NaNO2为原理,利用下列装置制取NaNO2(夹持和加热仪器略)。
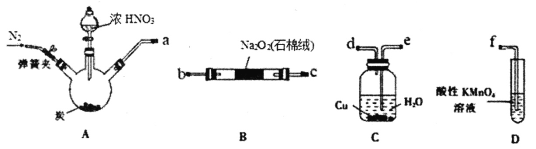
已知:①酸性KMnO4溶液可将NO及NO2-氧化为NO3-,MnO4-被还原为Mn2+。
②HNO2具有不稳定性:2HNO2=NO2↑+NO↑+H2O。
回答下列问题:
(1)按气流方向连接仪器接口______________(填接口字母)。
(2)实验过程中C装置内观察到的现象是___________________________。
(3)Na2O2充分反应后,测定NaNO2含量:称取反应后B中固体样品3.45g溶于蒸馏水,冷却后用0.50mol· L-1酸性KMnO4标准液滴定。重复三次,标准液平均用量为20.00mL。
①该测定实验需要用到下列仪器中的___________(填序号)。
a.锥形瓶 b.容量瓶 c.胶头滴管 d.酸式滴定管 e.碱式滴定管 f.玻璃棒
②假定其他物质不与KMnO4反应,则固体样品中NaNO2的纯度为____%。
③实验得到NaNO2的含量明显偏低,分析样品中含有的主要杂质为_____(填化学式)。为提高产品含量,对实验装置的改进是在B装置之前加装盛有_____(填药品名称)的______(填仪器名称)。
(4)设计一个实验方案证明酸性条件下NaNO2具有氧化性________________________。
(提供的试剂:0.10mol·L-1NaNO2溶液、KMnO4溶液、0.10mol·L-1KI溶液、淀粉溶液、稀硝酸、稀硫酸)
【答案】aedbc(或cb)f 固体逐渐溶解,溶液变为蓝色,有无色气泡产生 adf 50% Na2CO3、NaOH 碱石灰(或氢氧化钠固体) 干燥管(或U形管) 取少量KI溶液和NaNO2溶液于试管,滴加几滴淀粉溶液不变色,然后滴加一定量稀硫酸,溶液变蓝,证明酸性条件下NaNO2具有氧化性(或取少量KI溶液和稀硫酸于试管,然后滴加几滴淀粉溶液不变色,滴加NaNO2溶液,溶液变为蓝色,证明酸性条件下NaNO2具有氧化性)
【解析】
本题表面考查了2NO+Na2O2=2NaNO2,该反应是陌生反应,但实际主要以基础知识为主,例如NO、Na2O2,NO2-等性质,本题综合性强,难度偏大。
(1)A中浓硝酸与炭反应生成NO2,NO2通入C装置可产生NO,因而按气流方向连接仪器接口aed,注意长进短出,然后NO和B中Na2O2反应,最后D为除杂装置,因而后续连接顺序为bc(或cb)f,该处答案为aedbc(或cb)f;
(2)NO2与水反应可得稀硝酸和NO,稀硝酸(包含挥发的硝酸)与Cu反应得到硝酸铜和NO,NO为无色气体,因而C中现象为固体逐渐溶解,溶液变为蓝色,有无色气泡产生;
(3)①酸性KMnO4标准液有腐蚀性,因而选用酸式滴定管,锥形瓶盛放待测液,玻璃棒溶解和转移固体,因而选adf;
②高锰酸钾与亚硝酸钠的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,n(NO2-)=![]() mol=0.025mol,m(NaNO2)=0.025mol×69g/mol=1.725g,则固体样品中NaNO2的纯度为
mol=0.025mol,m(NaNO2)=0.025mol×69g/mol=1.725g,则固体样品中NaNO2的纯度为![]() ×100%=50%;
×100%=50%;
③碳和浓硝酸反应得到CO2,同时C中会有水蒸气进入B中,CO2和水分别与Na2O2反应得到Na2CO3、NaOH,样品中含有的主要杂质为Na2CO3、NaOH,同时除去CO2和H2O,可使用碱石灰(或氢氧化钠固体),该药品可装在干燥管内或U形管中;
(4)要想证明酸性条件下NaNO2具有氧化性,需要选用合适的还原剂(如KI溶液)与之反应,并且能够观察到明显的反应现象(如淀粉遇碘变蓝),根据提供的试剂可选用0.10mol·L-1NaNO2溶液、0.10mol·L-1KI溶液、淀粉溶液、稀硫酸,注意用稀硫酸酸化,稀硝酸有强氧化性干扰实验。因而实验过程为取少量KI溶液和NaNO2溶液于试管,滴加几滴淀粉溶液不变色,然后滴加一定量稀硫酸,溶液变蓝,证明酸性条件下NaNO2具有氧化性(或取少量KI溶液和稀硫酸于试管,然后滴加几滴淀粉溶液不变色,滴加NaNO2溶液,溶液变为蓝色,证明酸性条件下NaNO2具有氧化性)。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 次氯酸的结构式:H—Cl—O B. 乙醇的结构简式: C2H6O
C. 硫离子的结构示意图:![]() D. 丙烷分子的球棍模型:
D. 丙烷分子的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4 溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() ―→Mn2++NO3-+H2O。下列叙述中正确的是
―→Mn2++NO3-+H2O。下列叙述中正确的是
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH增大
C. 生成1 mol NaNO3需消耗0.2 mol KMnO4
D. ![]() 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有N、P、Fe、Ti等元素的新型材料有着广泛的用途。
(1)基态Fe原子未成对电子数为______个;基态Ti原子的价电子排布图是_____________。
(2)意大利罗马大学的:FuNvio Cacace等人获得了极具理论研究意义的N4分子,其中氮原子的轨道杂化形式为__________________________。
(3)比较气态氢化物膦(PH3)和氨(NH3)的键角:PH3________NH3(填“大于”、“小于”或“等于”),主要原因为____________________________________________________________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。
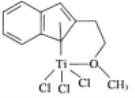
①组成M的元素中,电负性最大的是___________(填名称)。
②M中含有_________(填标号)。
A π键 B σ键
C 离子键 D 配位键
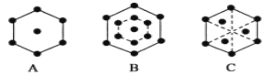
(5)已知金刚石的晶胞沿其体对角线垂直在纸平面上的投影图如下图B所示,则金属铁晶胞沿其体对角线垂直在纸平面上的投影图应该是图__________(填标号)。
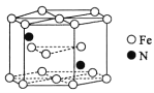
(6)某种磁性氮化铁的晶胞结构如图所示,其中距离铁原子最近的铁原子的个数为____________,氮化铁晶胞底边长为a cm,高为c cm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1,则甲烷的燃烧热为893.0kJ·mol-1
B.已知4P(红磷,s)=P4(白磷,s);ΔH>0,则白磷比红磷稳定
C.含20.0gNaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,反应的热化学方程式为:NaOH(aq)+![]() H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.4kJ·mol-1
H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.4kJ·mol-1
D.己知C(s)+O2(g)=CO2(g);ΔH1 C(s)+![]() O2(g)=CO(g);ΔH2,则ΔH1>ΔH2
O2(g)=CO(g);ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
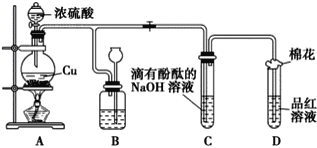
(1)装置A中发生的化学反应的化学方程式为________________________________
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________(填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________性
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题:
Ⅰ.直接法

(1)气体X为___(填化学式)。
(2)“转化”步骤发生反应的离子反应方程式___(已知:Ca3(PO4)2难溶于水)。
(3)滤液①中加入甲醇的作用是___。
(4)“操作Ⅰ”是___。
Ⅱ.酸碱中和法
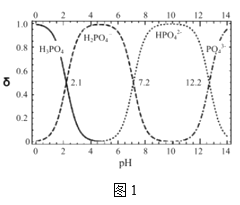
(5)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。写出此反应的离子反应方程式___。由图1判断制备磷酸二氢钾(达80%)的最佳pH范围___。
Ⅲ.电解法
电解法制取KH2PO4的原理如图2所示。一定件下,还可得到NaClO3。
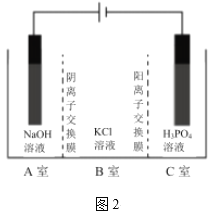
(6)在___室(填标号)可得到KH2PO4;写出产生ClO3-,的电极反应式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com