
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
分析 由短周期主族元素X、Y、Z、W在元素周期表中的相对位置,可知X处于第二周期,Y、Z、W处于第三周期,由位置可知X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a,X的最低负化合价为(a+4)-8,则X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,可知Y为Mg,则Z为Si、W为P、X为O,以此来解答.
解答 解:由短周期主族元素X、Y、Z、W在元素周期表中的相对位置,可知X处于第二周期,Y、Z、W处于第三周期,由位置可知X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a,X的最低负化合价为(a+4)-8,则X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,可知Y为Mg,则Z为Si、W为P、X为O,
A.X分别与Y、Z形成的化合物为MgO、SiO2,MgO属于离子化合物,含有离子键,而SiO2属于共价化合物,含有共价键,故A错误;
B.非金属性W>Z,故Z的最高价氧化物的水化物酸性比W的弱,故B错误;
C.非金属性X>W,故X的简单气态氢化物的稳定性比W的强,故C正确;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:r(Y)>r(Z)>r(W)>r(X),故D正确;
故选CD.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素的化合价及最外层电子推断元素为解答的关键,侧重分析、推断及应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
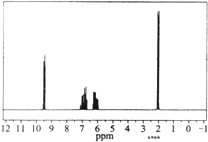
| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
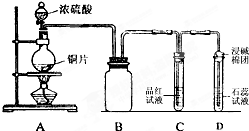 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
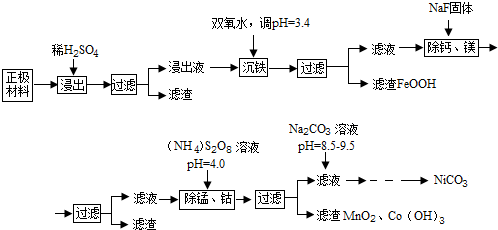
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
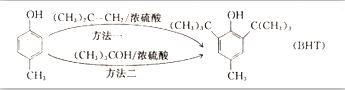
| A. | 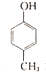 有五种同分异构体 有五种同分异构体 | B. | 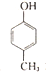 与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT具有还原性不能发生还原反应 | D. | 两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com