D
分析:A、依据气体摩尔体积的条件应用分析判断;
B、质量换算物质的量,结合晶体构成是钠离子和硫酸氢根离子分析;
C、一氧化氮和氧气反应,生成的二氧化氮存在二氧化氮和四氧化二氮的化学平衡;
D、S
2和S
8都是硫元素组成,只需要计算6.4g硫元素物质的量即可.
解答:A、温度压强不知,4.48L气体物质的量不是0.2mol,故A错误;
B、1.2g NaHSO
4晶体物质的量=
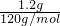
=0.01mol,含钠离子0.01mol,含硫酸氢根离子0.01mol,含阳离子和阴离子的总数为0.02N
A,故B错误;
C、标准状况下,44.8 L NO物质的量为2mol,与22.4 LO
2物质的量为1mol,混合后发生反应2NO+O
2=2NO
2;生成二氧化氮2mol,但存在平衡2NO
2?N
2O
4;所以44.8 L NO与22.4 LO
2混合后气体中分子总数小于2N
A,故C错误;
D、S
2和S
8的混合物共6.4g含硫元素物质的量=
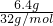
=0.2mol,所含硫原子数一定为0.2N
A,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,气体摩尔体积的条件应用,质量换算物质的量计算微粒数,关键是硫酸氢钠晶体是由钠离子和硫酸氢根离子构成.

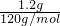 =0.01mol,含钠离子0.01mol,含硫酸氢根离子0.01mol,含阳离子和阴离子的总数为0.02NA,故B错误;
=0.01mol,含钠离子0.01mol,含硫酸氢根离子0.01mol,含阳离子和阴离子的总数为0.02NA,故B错误;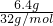 =0.2mol,所含硫原子数一定为0.2NA,故D正确;
=0.2mol,所含硫原子数一定为0.2NA,故D正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案