
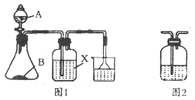
 某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:
某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:分析 (1)根据经济性原则,从消耗硫酸的量分析,途径I消耗的硫酸少,途径I更合理;
(2)探究二氧化硫的性质:AB制取二氧化硫,X探究二氧化硫具有漂白性或还原性或氧化性,二氧化硫有毒,不能直接排放,需要用氢氧化钠溶液吸收,倒扣漏斗的作用是防止倒吸.为防止产生倒吸现象,尾气处理中用倒置漏斗;途径INa2SO3固体与较浓的硫酸(约70%)反应生成硫酸钠和水、二氧化硫.
解答 解:(1)制备等量的二氧化硫,途径I:反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,途径II:化学反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,途径I消耗的硫酸少,故途径I更合理,
故答案为:途径I;制备等量的二氧化硫消耗的硫酸少;
(2)①二氧化硫是有毒气体,是形成酸雨的主要气体,二氧化硫极易和NaOH溶液反应而导致压强急剧减小,为防止产生倒吸现象,尾气处理中用倒置漏斗,
故答案为:防止倒吸;
②根据强酸制弱酸的原理,硫酸的酸性强于亚硫酸,Na2SO3固体与较浓的硫酸(约70%)反应,化学反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
点评 本题考查二氧化硫的制备实验及评价,为高频考点,把握制备原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
 ,反应中其还原剂是Na2O2.
,反应中其还原剂是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
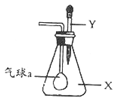 如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )
如图,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( )| A. | X是氨气,Y是硫酸钠溶液 | B. | X是SO2,Y是Ba(OH)2溶液 | ||
| C. | X是CO2.Y是硫酸溶液 | D. | X是HC1,Y是氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2•12H2O能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | SO2有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | MnO2有较强的氧化性,可作H2O2分解的氧化剂 | |
| D. | Si是半导体材料,可用于制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金一定是由两种或多种金属熔合而成的 | |
| B. | 日常生活中用到的五角硬币属于铜合金 | |
| C. | 铝合金的硬度比铝的大,熔点比铝的高 | |
| D. | 商代的司母戊鼎是由纯铜打造而成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com