
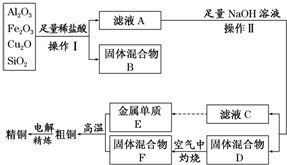
分析 Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可得纯铜,以此解答该题.
(1)根据分离溶液和沉淀选择操作;根据灼烧过程所需要用到的仪器分析即可;
(2)Al2O3、Fe2O3均与盐酸反应生成对应的阳离子,由于Cu2O+2H+=Cu+Cu2++H2O,又因为Cu+2Fe3+═Cu2++2Fe2+,故溶液中铁主要存在Fe2+,检验二价铁的方法是取少量样品加入硫氰化钾溶液,无明显现象,再加新制氯水,出现血红色即可;
(3)根据铝热反应的原理来书写;
(4)设溶液的PH为X,然后求出由水电离出的c(OH-),利用由水电离出的c(OH-)前者为后者的108倍求出X;
(5)a.电能转化为化学能、热能;
b.粗铜接电源正极,失去电子,发生氧化反应;
c.精铜作阴极,电解后电解液中Cu2+浓度减小;
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系;
(6)要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.
解答 解:Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可得纯铜.
(1)实验操作I步骤中分离溶液和沉淀的操作名称为过滤,在空气中灼烧固体混合物D时,所用到的仪器有坩埚、泥三角、三角架、酒精灯,玻璃棒,
故答案为:过滤;坩埚;
(2)Al2O3、Fe2O3均与盐酸反应生成对应的阳离子,由于Cu2O+2H+=Cu+Cu2++H2O,又因为Cu+2Fe3+═Cu2++2Fe2+,故溶液中铁主要存在Fe2+,检验二价铁的方法是取少量样品加入硫氰化钾溶液,无明显现象,再加新制氯水,出现血红色即可,
故答案为:Fe2+;Cu+2Fe3+═Cu2++2Fe2+;硫氰化钾溶液和新制氯水;
(3)铝与氧化铁发生铝热反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)设溶液的PH为X,NaAlO2溶液中由水电离出的c(OH-)=10X-14mol/L,NaOH溶液中由水电离出的c(OH-)=10-Xmol/L,$\frac{1{0}^{X-14}}{1{0}^{-X}}$=108,解得X=11,
故答案为:11;
(5)①a.电能部分转化为化学能,故a错误;
b.粗铜接电源正极,失去电子,发生氧化反应,故b正确;
c.精铜作阴极,电解后电解液中Cu2+浓度减小,故c正确;
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系:比如电路中通过3.01×1023个电子,得到精铜的质量为16g,故d错误;
故答案为:bc;
(6)要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可,
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后.
点评 本题以矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜为背景,考查物质的制备以及分离和提纯等知识,涉及物质的性质、化学方程式、电解原理等,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | (CH3)2CHCH2CH3 | D. | CH3C(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 若反应物所具有的总能量小于生成物所具有的总能量,则发生的是放热反应 | |
| C. | 稀H2SO4溶液与稀Ba(OH)2溶液反应生成lmol H2O时放出的热量叫中和热 | |
| D. | 1molH2与0.5molO2反应放出的热量就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O | |
| B. | 向NaOH溶液中通入少量的CO2:OH-+CO2=HCO3- | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com