
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)滴定管在装液时,为了防止溶液被稀释,需用待装液润洗;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点.
解答 解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:BECDAF;
故答案为:BDCEAF;
(2)上述(B)操作的目的是防止将标准液稀释,
故答案为:防止将标准液稀释;
(3)上述(A)操作之前,锥形瓶水洗后没干燥,待测液的物质的量不变,则消耗的标准液体积不变,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)不变;
故答案为:不变;
(4)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;溶液颜色由无色变浅红且保持30秒内不褪色.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ•mol-1 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质沸点高低顺序为:W<X<Y<Z | |
| B. | 原子半径大小顺序为:W<X<Y<Z | |
| C. | 元素的非金属性强弱顺序为:W<X<Y<Z | |
| D. | 四种元素可以共存于一种离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
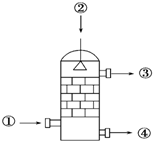 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 | |
| B. | 溶液呈中性,只能选用石蕊作指示剂 | |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 | |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
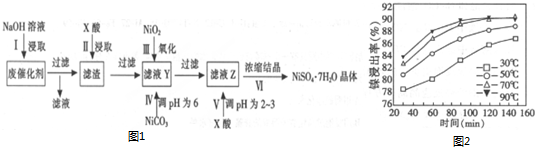
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
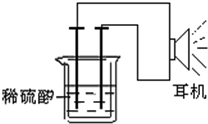 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com