
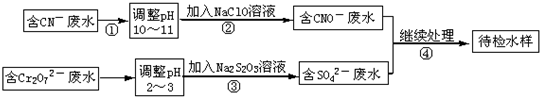
| 1 |
| 2 |
2- 7 |
2- 7 |
2- 7 |
| 16.8g |
| 56g/mol |
| 0.3mol×1 |
| 6 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.8mL浓H2SO4 |
| B、用碱式滴定管量取18.20mLKMnO4溶液 |
| C、酸碱中和滴定时,滴定管和锥形瓶需分别用标准液和待测液润洗 |
| D、读取标准液读数时,若滴定前仰视,滴定后俯视,会导致测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质名称 | 溶度积(Ksp) | pH | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)2 | 8.0×10-16 | 7.6 | 9.6 |
| Fe(OH)3 | 2.8×10-39 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示向1L浓度均为0.1mol.L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1mol.L-1稀H2SO4溶液 |
B、 表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 |
C、 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
D、 表示向醋酸溶液中滴入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
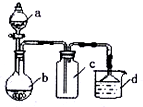 实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硝酸 | Cu | NO2 | H2O |
| C | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| D | 浓盐酸 | KClO3 | Cl2 | 澄清石灰水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )| A、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C、若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D、在D点:c(NH4+)+c(NH3?H2O)=2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯物质 | 除杂试剂(操作) | 分离方法 | |
| A | 溴乙烷(Br2) | Na2SO3溶液 | 分液 |
| B | NH4Cl(I2) | 加热 | 升华 |
| C | 乙烷(乙烯) | 酸性KmnO4溶液 | 洗气 |
| D | Al(OH)3胶体(N aCl固体) | 溶于水 | 抽滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=5.0mol?L-1?min-1 |
| B、v(B)=2.0mol?L-1?min-1 |
| C、v(C)=0.9mol?L-1?s-1 |
| D、v(D)=1.0mol?L-1?s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com