
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
分析 亚铁离子的还原性小于碘离子,溴少量时碘离子优先被氧化,发生反应为:2I-+Br2═I2+2Br-;当碘离子完全被氧化后,亚铁离子开始被溴单质氧化,溴足量时的反应方程式为:2Fe2++4I-+3Br2═2Fe3++2I2+6Br-,据此进行解答.
解答 解:亚铁离子的还原性小于碘离子,溴少量时碘离子优先被氧化,发生反应为:2I-+Br2═I2+2Br-;当碘离子完全被氧化后,亚铁离子开始被溴单质氧化,溴足量时的反应方程式为:2Fe2++4I-+3Br2═2Fe3++2I2+6Br-,
A.a=0.1时,溴单质不足,只有碘离子被氧化,反应的离子方程式为:2I-+Br2═I2+2Br-,故A正确;
B.当a=0.25时,0.2molFeI2的溶液中含有0.2mol亚铁离子、0.4mol碘离子,0.4mol碘离子完全反应消耗0.2mol溴单质,剩余的0.05mol溴单质能够氧化0.1mol亚铁离子,所以正确的反应为:2Fe2++8I-+5Br2═2Fe3++4I2+10Br-,故B错误;
C.溶液中含有0.4mol碘离子,当有0.2mol碘离子被氧化时,消耗0.1mol溴单质生成0.2mol溴离子,则反应后溶液中碘离子和溴离子浓度相等,故C正确;
D.当0.2<a<0.3时,碘离子完全被氧化,亚铁离子部分被氧化,根据电荷守恒可知溶液中的离子浓度的关系为:2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-),故D正确;
故选B.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确亚铁离子与碘离子的还原性强弱及发生反应的先后顺序为解答关键,试题充分培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 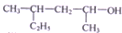 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的质子数为94,中子数为238,电子数为144 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
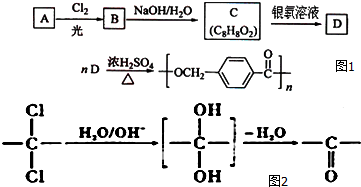
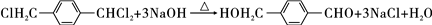 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是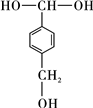 .
.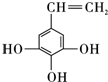 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
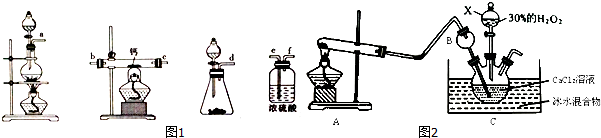
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于加工食品,使食品增白 | |
| B. | NaOH可用于清洗抽油烟机 | |
| C. | 葡萄糖可用于合成保健药物维生素C | |
| D. | 聚丙烯塑料可用作食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用浓硝酸与Cu反应制NO2 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | NO2溶于水时发生氧化还原反应 | D. | 过量的铜与浓硝酸反应有N0生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com