
| A. | b、d、e | B. | b、c、e、f | C. | a、b、c | D. | b、c、d、e |
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 弱酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热是反应热的两种 | |
| D. | 101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子,如果核外电子数相同,则一定属于同种元素 | |
| B. | 两种微粒,若核外电子数相同,则其化学性质一定相同 | |
| C. | 在多电子的原子里不同电子层的核外电子的能量是不相同的 | |
| D. | 能量低的电子在离核近的区域运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
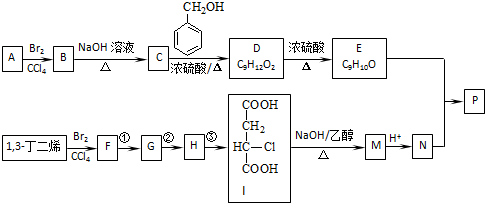
 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)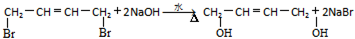 .
.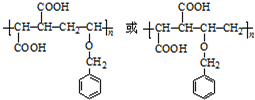 .
.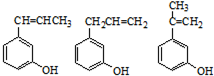 (其中任一种).
(其中任一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.25mol•L-1 | C. | 0.45mol•L-1 | D. | 0.225mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
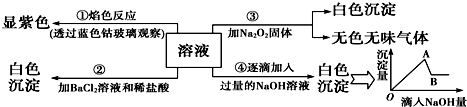
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com