
科学家预言,燃料电池将是 21 世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,工作原理是将电极插入KOH溶液中,然后在两极分别添加甲醇和氧气,若a极上添加甲醇; b极:2H2O+O2+4e-=4OH-。 关于此燃料电池的下列说法中错误的是( )
A.a极为负极,b极为正极。
B.放电过程中,a、b电极上均发生氧化还原反应。
C.该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH-―6e-=CO32-+6H2O
D.若用此电源电解饱和食盐水,每消耗0.1molO2则阴极理论上生成0.2molCl2。
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:填空题
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是________。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸 点都比二氧化硅晶体的低
点都比二氧化硅晶体的低
(2)Mn和 Fe的部分电离能数据如下表:
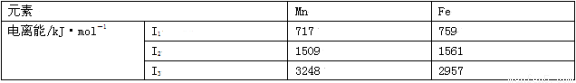
Mn元素价电子排布式为________,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是___________________________。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于_______区。
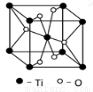
(5)Ti的一种氧化物X,其晶胞结构如图所示,则 X的化学式为___________。
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___________
②与CNO-互为等电子体微粒的化学式为__________(写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:简答题
镀镍废水中含有氰根(CN-),其质量浓度往往高于国家排放标准规定的范围,需要进行破氰处理。用化学法处理电镀废水中的氰化物,一般采用碱性氰化法和双氧水氧化法。
I、碱性氯化法是在废水中加入NaOH使Ni2+生成Ni(OH)2沉淀,同时加NaClO将CN-氧化为无毒物质,但此法中ClO-在碱性条件下会和Ni2+反应生Ni(OH)3沉淀和Cl-而大量消耗,反应的离子反应方程式为_______________________________________;
Ⅱ、双氧水氧化法的简易工艺流程如下:
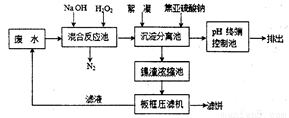
(1)混合反应池中,在碱性条件下H2O2氧化CN-却不会和Ni2+反应,此反应的离子方程式为______________;H2O2还会以质量比为25:2的比例氧化废水中的有机添加剂,降低废水的COD值。
(2)沉淀分离池中,加入焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2,否则会影响沉淀的絮凝沉降,请分析原因________________________________;
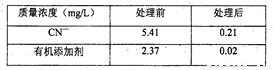
(3)向废水中加入30%H2O2(密度为1.11g/mL)的用量为1mL/L,处理前后CN-和有机添加剂的质量浓度如下表所示,若不考虑H2O2的自身分解和溶液体积的变化。请计算需在沉淀分离池中至少加入焦亚硫 酸钠(Na2S2O5)的量为_________g/L(计算结果保留到小数点后两位)。写出计算过程。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:计算题
现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
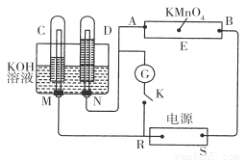
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:推断题
毗氟氯禾灵的合成路线如下:
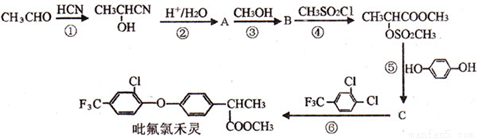
已知: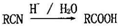
(1)B的结构简式为_____________。A的系统名称为_____________。
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有___________(填序号)。
(3)写出反应⑥的化学方程式___________________。
(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式___________________。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由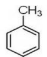 制备高分子化合物
制备高分子化合物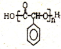 的合成路线流程图(无机试剂任选),合成流程示意图如下:
的合成路线流程图(无机试剂任选),合成流程示意图如下: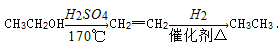
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
现有M、X、A、E4种元素的单质,能发生以下反应
①在水溶液中,M+X2+=M2++X
②A+2H2O(冷)===A(OH)2+H2↑
③X、E相连浸入稀H2SO4中,电极反应为:X-2e-=X2+,2H++2e-=H2↑
判断它们的还原性由强到弱的顺序是( )
A.M、X、A、E B.A、M、X、E C.M、X、E、A D.E、A、M
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷(解析版) 题型:填空题
Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
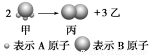
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液:  。
。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com