



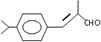
 ,B→C发生加成反应,C为
,B→C发生加成反应,C为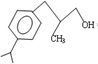 ,C→兔耳草醛发生醇的催化氧化反应,据此分析解答;
,C→兔耳草醛发生醇的催化氧化反应,据此分析解答; ,B→C发生加成反应,C为
,B→C发生加成反应,C为 ,C→兔耳草醛发生醇的催化氧化反应,
,C→兔耳草醛发生醇的催化氧化反应,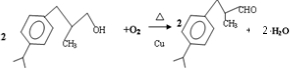 ,故答案为:
,故答案为: ;
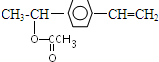
;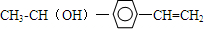 ,与乙酸反应的化学方程式:
,与乙酸反应的化学方程式: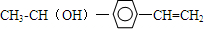 +CH3COOH
+CH3COOH| 浓硫酸 |
| △ |
 ,
,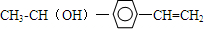 +CH3COOH
+CH3COOH| 浓硫酸 |
| △ |
 .
.


科目:高中化学 来源: 题型:
| A、固体的热稳定性:Na2CO3>CaCO3>NaHCO3 |
| B、金属活动性Li>Na>K |
| C、氧化物的稳定性:H2Se>H2S |
| D、微粒半径:K+>S2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:
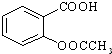 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: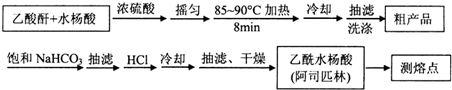
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
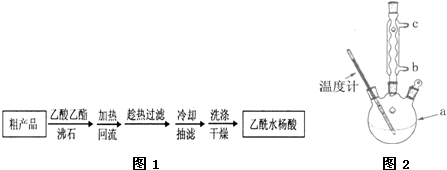
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钡原子的核外电子排布 |
| B、钡元素在周期表中的位置 |
| C、钡原子的核电荷数 |
| D、钡元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
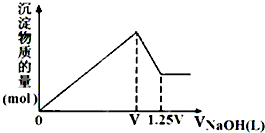 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、OH-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
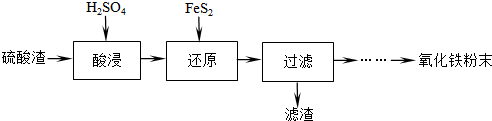
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com