
| A. | 当A是正盐,X是强酸时,D是酸性氧化物 | |
| B. | 当X时强碱溶液时,B一定时NH3 | |
| C. | B可能是单质 | |
| D. | D可能是一种酸 |
分析 A、当A是正盐,X是强酸时,D是酸性氧化物,则题中可以发生的各物质的转化为:Na2S$\stackrel{H+}{→}$H2S $\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3,分析判断;
B、若X为强碱溶液时,则题中可以发生的各物质的转化为:NH4+$\stackrel{OH-}{→}$NH3 $\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,也可以是RCH2-X$\stackrel{OH-}{→}$RCH2-OH $\stackrel{O_{2}}{→}$RCHO$\stackrel{O_{2}}{→}$RCOOH,据此判断;
C、若B为S或N2,经两步氧化可得到三氧化硫或二氧化氮;
D、D是由B以两步氧化得到的,可以是RCH2-X$\stackrel{OH-}{→}$RCH2-OH $\stackrel{O_{2}}{→}$RCHO$\stackrel{O_{2}}{→}$RCOOH,据此答题.
解答 解:A、当题中发生的转化为:Na2S$\stackrel{H+}{→}$H2S $\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3时,满足A是正盐,X是强酸时,D是酸性氧化物,故A正确;
B、若X为强碱溶液时,则题中可以发生的各物质的转化为:NH4+$\stackrel{OH-}{→}$NH3 $\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,也可以是RCH2-X$\stackrel{OH-}{→}$RCH2-OH $\stackrel{O_{2}}{→}$RCHO$\stackrel{O_{2}}{→}$RCOOH,所以B不一定是氨气,也可以是醇,故B错误;
C、A与X可以通过氧化还原反应生成B为S或N2,经两步氧化可得到三氧化硫或二氧化氮,故C正确;
D、根据题中转化关系,若为:RCH2-X$\stackrel{OH-}{→}$RCH2-OH $\stackrel{O_{2}}{→}$RCHO$\stackrel{O_{2}}{→}$RCOOH,则D为羧酸,故D正确,
故选B.
点评 本题考查了物质转化关系的应用,物质特征性质的综合应用,主要是依据反应条件结合具体实例进行分析判断.


科目:高中化学 来源: 题型:实验题
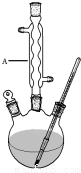 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(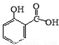 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中性溶液中pD=8-lg4 | |
| B. | 含有0.01 mol NaOD的D2O溶液1 L,pD=12.0 | |
| C. | 溶解0.01 mol DCl的D2O溶液1 L,pD=12.0 | |
| D. | 在100 mL 0.25 mol/L的DCl重水溶液中,加入50 mL 0.20 mol/L NaOD重水溶液,pD=1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d | B. | 2d | C. | 3d | D. | 4d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入氢氧化钠溶液:CO32-+H++OH-=CO32-+H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2O | |
| C. | 用NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 向氢氧化钠溶液中通入过量的二氧化碳:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com