
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
 +
+
![]()
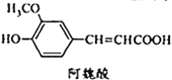 +H2O+CO2
+H2O+CO2
下列说法正确的是
A.可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与![]() 、NaOH溶液反应
、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有5种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
科目:高中化学 来源: 题型:
【题目】在一定温度(T)时,X2(g)和H2反应生成HX的平衡常数如下表。
化学方程式 | K(T) |
F2+H2 | 1.8×1036 |
Cl2+H2 | 9.7×1022 |
Br2+H2 | 5.6×107 |
I2+H2 | 43 |
(1)I 有多种同位素,![]() 的中子数为______。
的中子数为______。
(2)用电子式表示HCl的形成过程______。
(3)下列说法正确的是______。
a 共价键的极性:HF>HCl
b 氯和溴氢化物性质的热稳定性:HCl>HBr
c 原子半径:S<Cl
d 酸性:H2SO4<HClO
(4)K的变化体现出X2化学性质的递变性,用原子结构解释X2得电子能力变化的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是
A.醋酸分子不可能存在于pH>7的碱性溶液中
B.NaCl溶液与CH3COONH4溶液均呈中性,所以等物质的量浓度的两种溶液中水的电离程度相等。
C.0.1mol·L-1硫化钠溶液中粒子浓度的关系:c(OH-)- c(H+)=c(HS-)+c(H2S)
D.同浓度的溶液:①(NH4)2SO4、②NH4HSO4、③NH4Cl中,c(NH4+)由大到小的顺序是①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH4Al(SO4)2可作净水剂,其理由是__________________(用必要的化学用语和相关文字说明).
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.![]()
C.c(H+)·c(OH-) D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据一定增大的是___________。
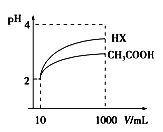
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________;稀释后,HX溶液中由水电离出来的c(H+)___________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =____________。
=____________。
(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为_____________.
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是一种天然除草剂,其结构如图所示,下列说法正确的是( )
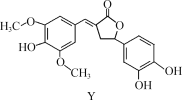
A.Y可以和Na2CO3溶液发生反应
B.Y分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与6 mol NaOH反应
D.Y与足量的H2加成反应的产物含7个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH=m的盐酸滴定20mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( )

A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
B.b点:MOH和HCl恰好完全反应
C.c点:c(H+)=c(OH-)+c(MOH)
D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为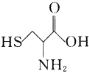 ,下列关于半胱氨酸说法不正确的是
,下列关于半胱氨酸说法不正确的是
A. 能溶于水、乙醇等溶剂
B. 既能与盐酸、又能与NaOH溶液反应
C. 与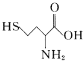 (高半胱氨酸)互为同系物
(高半胱氨酸)互为同系物
D. 官能团不变的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO2-+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com