
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室配制220mL 1 mol·L-1的稀H2SO4溶液:
(1)用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为________mL。
(2)误差下列情况使配制结果偏大的是________。
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
II.某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。制备气体的实验装置有(可重复选用):
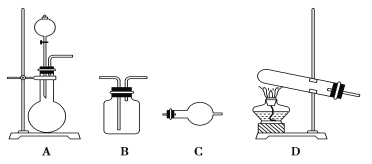
实验药品有:a.MnO2(s) b.浓盐酸 c.NH4Cl(S) d.KClO3(s) e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。发生反应的化学方程式为_________________________________。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号) 。
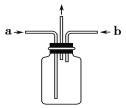
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是_______,若氨气量较多,则瓶内会出现大量白烟,该白烟为___________。
(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为______________________________________。
【答案】13.6 ①④ D、C 2NH4Cl +CaOH)2 =CaCl2+2NH3↑+2H2O g、f 氨气(NH3) 氯化铵(NH4Cl) 3Cl2+NH3=NCl3+3HCl
【解析】
I.(1)需要选用规格为250mL的容量瓶配制,实际配制的是250mL1mol·L-1的稀硫酸溶液,配制过程中硫酸的物质的量不变,设需要浓硫酸的体积为xmL,则:1.84g·mL-1 xmL98%=98g/moL1mol/L0.25L,据此计算即可;
(2)根据操作方法对![]() 的影响分析误差;
的影响分析误差;
II.(1)实验室制取氨气的方法是用加热铵盐与消石灰来制取氨气,选择固固加热的制取装置,根据要求选择干燥装置;
(2)A为发生装置,产生的氯气中含有氯化氢、水等杂质,选择合适的试剂依次除杂;
(3)根据两种气体的密度选择通入的方向,白烟是由固体小颗粒分散到空气中形成的,由反应的生成物分析白烟的成分;
(4)根据题意,可推知产物中有NCl3生成,根据元素守恒写出化学方程式。
根据以上分析进行解答。
I.(1)实验室配制220mL 1 mol·L-1的稀H2SO4溶液,需要选用规格为250mL的容量瓶配制,实际配制的是250mL1mol·L-1的稀硫酸溶液,配制过程中硫酸的物质的量不变,设需要浓硫酸的体积为xmL,则:1.84g·mL-1 xmL98%=0.25L1mol/L98g/moL,解得x=13.6;
答案为:13.6;
(2)①溶解后未冷却即转移、定容,配制的溶液体积偏小,溶液浓度偏大,①正确;
②定容时仰视容量瓶刻度线,配制的溶液体积偏大,溶液浓度偏小,②错误;
③用量筒量取一定体积的浓硫酸时俯视,量取的浓硫酸体积偏小,配制的溶液浓度偏小,③错误;
④不需要洗涤量筒,若将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶,导致浓硫酸的物质的量偏大,溶液浓度偏大,④正确;
答案为:①④;
II.(1)实验室制取氨气的方法是用加热氯化铵与消石灰来制取氨气,反应的化学方程式为:2NH4Cl +CaOH)2 === CaCl2+2NH3↑+2H2O,选择固固加热的制取装置D,氨气一般用碱石灰来干燥,干燥装置为C;
答案为:D、C;2NH4Cl +CaOH)2 === CaCl2+2NH3↑+2H2O;
(2)制取干燥氯气的装置由A、B、B组装而成,A为气体发生装置,产生的氯气中含有氯化氢、水等杂质,先用饱和食盐水除去氯化氢,再用浓硫酸除去水;
答案为:g、f;
(3)氯气的密度比空气大,氨气的密度比空气小,所以导管a中通入氨气可使反应在b的下端口进行,反应更加充分;两种气体反应后生成了氯化铵固体,固体小颗粒分散在瓶中形成白烟;
答案为:氨气(NH3);氯化铵(NH4Cl);
(4)根据题意可推知产物中空间构型与NH3相似的化合物为NCl3,由元素守恒可知另一生成的化合物为HCl,所以化学方程式为:3Cl2+NH3===NCl3+3HCl;
答案为:3Cl2+NH3===NCl3+3HCl;


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.10mol/L的Na2CO3溶液中逐滴加入0.10mol/L的盐酸,溶液pH的变化曲线如图所示。下列说法不正确的是
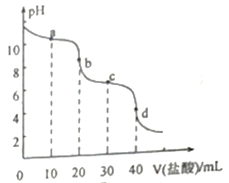
A. a点溶液中:c(HCO3-)>c(CO32-)
B. b点溶液中:c(H+)-c(OH-)= c(CO32-)- c(HCO3-)
C. c点溶液中:3c(Na+)=4c(Cl-)
D. d点溶液中: c(Na+)+ c(H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)+ c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是
A. 操作①和③中的有机相从分液漏斗下端放出
B. 操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2O
C. 操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶
D. 操作⑤可用如图所示的水浴装置进行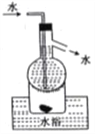
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol/L的![]() 溶液中含
溶液中含![]() 的数目为2NA
的数目为2NA
B.标准状况下,4.48L ![]() 中所含原子数目为0.2NA
中所含原子数目为0.2NA
C.常温常压下,28g ![]() 中所含分子数目为NA
中所含分子数目为NA
D.1mol Al与足量盐酸完全反应,转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回 答下列问题:
(1)键线式![]() 的系统命名为____________;
的系统命名为____________;
(2)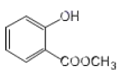 中含有官能团的名称为____________;
中含有官能团的名称为____________;
(3)2-甲基-1-丁烯的结构简式____________;
(4)相对分子质量为72且一氯代物只有一种的烷烃的结构简式____________;
(5) 的最简式为____________。
的最简式为____________。
(6)写出 中所含官能团的电子式:____________、____________。
中所含官能团的电子式:____________、____________。
(7)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是____________;
A.红外光谱 B.核磁共振氢谱 C.元素分析仪 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜与浓硫酸反应的实验装置图:
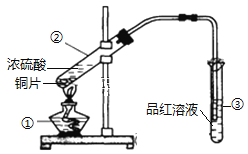
(1)仪器①的名称是_____________;
(2)实验过程中,试管③中发生的现象为____________________________________;
(3)试管②中铜与浓硫酸反应的化学方程式为 _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是

A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com