
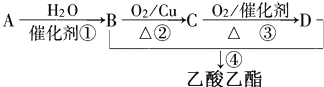
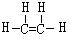 .
.
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应得到B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应得到D为CH3COOH,乙醇与乙酸发生酯化反应得到CH3COOCH2CH3,该反应为可逆反应,根据可逆反应的平衡状态的特征判断该反应是否处于平衡状态,由题中分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应得到B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应得到D为CH3COOH,乙醇与乙酸发生酯化反应得到CH3COOCH2CH3,
(1)A为乙烯,结构式为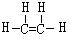 ,
,
故答案为: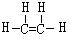 ;
;
(2)B为乙醇,含有官能团为羟基,D为乙酸,含有官能团为羧基,
故答案为:羟基;羧基;
(3)反应①是乙烯与水发生加成反应生成乙醇,反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
反应②是乙醇被氧化物乙醛,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应的化学方程式为:CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(4)反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应为可逆反应,
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都是指正反应速率,不能判断反应是否处于平衡状态;
②正反应的速率与逆反应的速率相等,则该反应处于平衡状态;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,则说明正逆反应速率相等,故反应处于平衡状态;
④混合物中各物质的浓度不再变化,则反应处于平衡状态;
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都是指正反应速率,不能说明正逆反应速率相等,故不能判断反应是否处于平衡状态;
故选②③④;
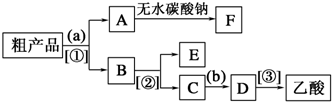
(5)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用浓硫酸反应得到乙酸,再蒸馏得到乙酸,
故答案为:饱和Na2CO3溶液;浓硫酸;分液;蒸馏.
点评 本题考查有机物推断及混合物分离提纯方法的实验设计,涉及烯烃、醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着核电荷数的递增而呈周期性变化 | |
| B. | 原子的原子核都是由质子和中子构成的 | |
| C. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| D. | 原子的次外层电子数不一定是8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
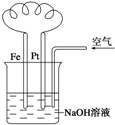
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是吸氧腐蚀的原电池装置 | |
| C. | Fe为正极,电极反应为:Fe-2e-+2OH-═Fe(OH)2 | |
| D. | NaOH溶液的碱性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 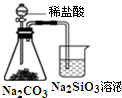 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. |  用图所示实验装置排空气法收集CO2气体 | |
| C. | 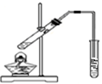 用图装置制备少量乙酸乙酯 | |
| D. | 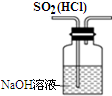 图装置可以用来除去SO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质在常温下都是固体 | |
| B. | 金属原子只有还原性,金属阳离子只有氧化性 | |
| C. | 含金属元素的离子都是阳离子 | |
| D. | 金属阳离子被还原不一定生成金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com