
| A. | 实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 | |
| B. | 检验硫酸亚铁铵晶体中是否含有结晶水:取一试管,用药匙加入2克硫酸亚铁铵晶体,并在试管口塞上一团蘸有少量无水硫酸铜粉末的棉花,同时塞紧塞子,点燃酒精灯加热试管,观察现象 | |
| C. | 取一药匙铁粉、半药匙食盐置于一片塑料薄膜上,混合均匀,滴一滴管水,包起塑料薄膜(不包紧,有空气),用手摸立刻有发烫感 | |
| D. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 |
分析 A.由于H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,据此分析;
B.塞紧塞子可能发生爆炸;
C.铁粉与水、氯化钠不反应;
D.中和滴定时,酸可滴定碱,也可碱滴定酸.
解答 解:A.由于H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,故A错误;
B.塞紧塞子可能发生爆炸,不需要塞塞子,故B错误;
C.铁粉与水、氯化钠不反应,无发烫感,故C错误;
D.中和滴定时,酸可滴定碱,也可碱滴定酸,即中和滴定时可用标准溶液滴定待测液,也可用待测液滴定标准溶液,故D正确.
故选D.
点评 本题考查较综合,涉及尾气处理、物质检验、中和滴定及物质的性质等,注重高频考点的考查,把握反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH 溶液、浓H2SO4 | B. | 溴的四氯化碳溶液、浓H2SO4 | ||
| C. | 乙醇、浓H2SO4 | D. | 酸性高锰酸钾溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
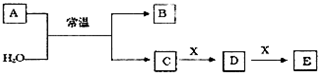
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 氢氧化钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
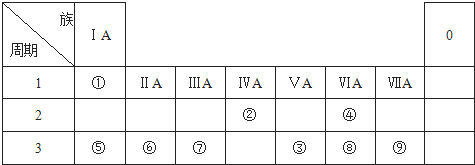
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
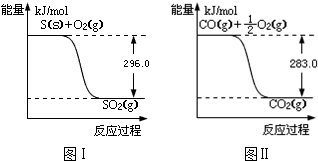
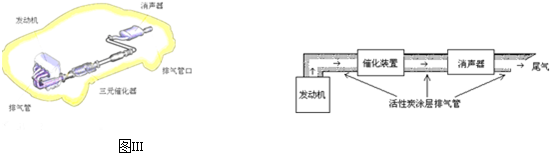
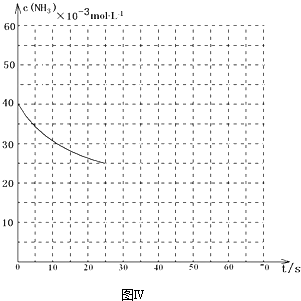
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
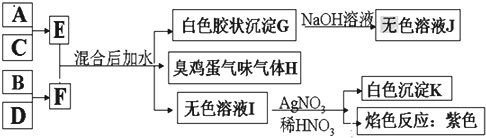
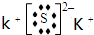 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com