
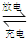 2PbSO4+2H2O放电时,正极电极反应式
2PbSO4+2H2O放电时,正极电极反应式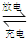 2PbSO4+2H2O 转移电子
2PbSO4+2H2O 转移电子

科目:高中化学 来源: 题型:
 (1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:
(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
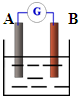
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
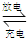
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省绵阳中学高一(下)期中化学试卷(解析版) 题型:解答题
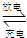 2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.
2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com