
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C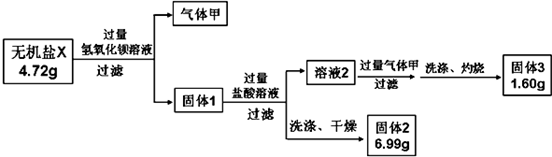
分析 Ⅰ、(1)将有色气体单质A通入到淀粉碘化钾溶液中,观察到溶液颜色先呈现蓝色,最后蓝色又褪去呈现无色,说明是强氧化性气体,先氧化碘离子为碘单质,继续氧化碘单质为碘酸钾,若在碘单质上直接通入气体A至生成物完全液化,得原子个数比为1:1的红棕色液体B,其化学性质与其组成元素的单质相似为卤素互化物,判断有色气体为氯气;
(2)B为卤素互化物ICl,形成的是共价键,性质和氯气性质相似,依据氯气具有的性质判断;
(3)溶液蓝色褪去的原因是氯气氧化碘单质为碘酸钾;
Ⅱ、(1)无机盐X与过量氢氧化钡溶液反应得到气体甲为氨气和固体1,说明X中含有铵根离子,固体1中加入过量盐酸过滤得到固体2为硫酸钡沉淀,证明X中含有硫酸根离子,溶液2中加入过量气体甲氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀,洗涤灼烧得到固体3为1.60g,将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224L,氨气和氧化铜反应生成氮气、铜和水蒸气,通过浓硫酸得到气体为氮气,则依据氮元素守恒,n(NH4+)=2n(N2)=2×$\frac{0.224L}{22.4L/mol}$=0.02mol,固体2为硫酸钡,n(SO42-)=n(BaSO4)=$\frac{6.99g}{233g/mol}$=0.03mol,硫酸铵中硫酸根离子为0.01mol,则金属形成的盐中硫酸根离子为0.02mol,结合电话守恒和原子守恒计算得到;
(2)溶液2中通入过量气体甲时发生的离子反应氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀;
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224L为氮气,氨气还原氧化铜为氧化亚铜;
(4)无机盐X中存在的金属阳离子为亚铁离子,依据亚铁离子检验方法,加入KSCN溶液雾变化,滴入氯水变红色证明.
解答 解:Ⅰ、(1)将有色气体单质A通入到淀粉碘化钾溶液中,观察到溶液颜色先呈现蓝色,最后蓝色又褪去呈现无色,说明是强氧化性气体,先氧化碘离子为碘单质,继续氧化碘单质为碘酸钾,若在碘单质上直接通入气体A至生成物完全液化,得原子个数比为1:1的红棕色液体B,其化学性质与其组成元素的单质相似为卤素互化物,判断有色气体A为氯气,组成气体A的元素在周期表中的位置第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(2)B为卤素互化物ICl,形成的是共价键,电子式为: ,性质和氯气性质相似,依据氯气具有的性质判断,氯气具有氧化性,所以ICl也具有氧化性,和水反应生成氯化氢和碘化氢,和乙烯发生加成反应,氧化二氧化硫为硫酸,与硫酸钠溶液不反应,
,性质和氯气性质相似,依据氯气具有的性质判断,氯气具有氧化性,所以ICl也具有氧化性,和水反应生成氯化氢和碘化氢,和乙烯发生加成反应,氧化二氧化硫为硫酸,与硫酸钠溶液不反应,
故答案为: ,C;
,C;
(3)溶液蓝色褪去的原因是氯气氧化碘单质为碘酸钾,反应的离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+,
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+;
Ⅱ、(1)无机盐X与过量氢氧化钡溶液反应得到气体甲为氨气和固体1,说明X中含有铵根离子,固体1中加入过量盐酸过滤得到固体2为硫酸钡沉淀,证明X中含有硫酸根离子,溶液2中加入过量气体甲氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀,洗涤灼烧得到固体3为1.60g,将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224L,氨气和氧化铜反应生成氮气、铜和水蒸气,通过浓硫酸得到气体为氮气,则依据氮元素守恒,n(NH4+)=2n(N2)=2×$\frac{0.224L}{22.4L/mol}$=0.02mol,固体2为硫酸钡,n(SO42-)=n(BaSO4)=$\frac{6.99g}{233g/mol}$=0.03mol,硫酸铵中硫酸根离子为0.01mol,则金属形成的盐中硫酸根离子为0.02mol,洗涤灼烧得到固体3为1.60g为氧化铁质量,物质的量=$\frac{1.60g}{160g/mol}$
=0.01mol,含铁元素0.02mol,X的化学式是(NH4)2SO4.2FeSO4.2H2O,固体2为硫酸钡,存在的化学键类型为离子键和共价键,
故答案为:(NH4)2SO4.2FeSO4.2H2O,离子键和共价键;
(2)溶液2中通入过量气体甲时发生的离子反应氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀,反应的离子方程式为:H++NH3=NH4+,Fe2++2NH3.H2O═Fe(OH)2+2NH4+,
故答案为:H++NH3=NH4+,Fe2++2NH3.H2O═Fe(OH)2+2NH4+;
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224L为氮气,氨气还原氧化铜为氧化亚铜,反应的化学方程式为:2NH3+6CuO═Cu2O+N2+3H2O,
故答案为:2NH3+6CuO═Cu2O+N2+3H2O;
(4)无机盐X中存在的金属阳离子为亚铁离子,依据亚铁离子检验方法,加入KSCN溶液雾变化,滴入氯水变红色证明,取少量无机盐X于试管中加水溶解,滴加几滴KSCN溶液,无明显现象,再滴加少量氯水,若溶液出现血红色,则证明存在Fe2+.
故答案为:取少量无机盐X于试管中加水溶解,滴加几滴KSCN溶液,无明显现象,再滴加少量氯水,若溶液出现血红色,则证明存在Fe2+.
点评 本题考查了物质性质,物质转化关系分析判断,反应现象的理解应用,注意物质组成的计算分析,掌握基础是关键,题目难度较大.


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | H2通入负极区 | B. | O2通入负极区 | ||
| C. | 负极反应为2H2-4e-═4H+ | D. | 溶液中OH-由正极向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:$NH_4^+、N{a^+}、F{e^{3+}}、SO_4^{2-}$ | |
| B. | 含有大量$AlO_2^-$的溶液中:$N{a^+}、{K^+}、HCO_3^-、NO_3^-$ | |
| C. | 中性溶液中:${K^+}、A{l^{3+}}、C{l^-}、SO_4^{2-}$ | |
| D. | Na2S溶液中:$SO_4^{2-}、{K^+}、C{u^{2+}}、C{l^-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮的化合物在工农业生产中应用广泛.
碳、氮的化合物在工农业生产中应用广泛.| 序号 | 实验条件 | 反应时间 | CO(g)/mol | H2(g)/mol | CH3OH(g)/mol |
| 实验Ⅰ | 恒温恒容 | 0min | 2 | 4 | 0 |
| 10min | 2.8 | ||||
| 20min | 1 | ||||
| 实验Ⅱ | 绝热恒容 | 0min | 2 | 4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
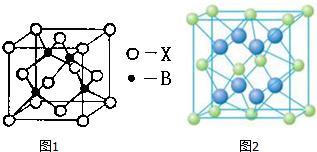
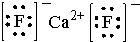 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com