
【题目】Ⅰ.当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热较大,可用作燃料。如图1表示乙烷、二甲醚燃烧过程中的能量变化。
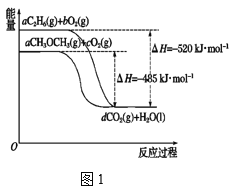
请回答下列问题:
(1)a=______。
(2)乙烷的燃烧热为______。
(3)等物质的量的C2H6(l)比C2H6(g)完全燃烧生成稳定的氧化物时放出的热量______(填“多”或“少”)。
(4)根据题图写出二甲醚完全燃烧时的热化学方程式:________。
(5)从环保角度分析,放出相同的热量时选择_______(填“乙烷”或“二甲醚”)作为燃料产生的二氧化碳较少。
Ⅱ.利用如图2装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/L NaOH 溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是_______。
(2)倒入NaOH溶液的正确操作是_______(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与 NaOH 溶液混合均匀的正确操作是_______。
(4)实验数据如下表:
温度实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①_______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 29.8 | ||
②近似认为0.55mol/LNaOH溶液和0.25mol/L 硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________(请答出两条)。
【答案】![]() -1560kJ·mol-1 少 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1 乙烷 保温隔热,减少热量的散失 A 用套在温度计上的环形玻璃棒上下搅动 3.4 -56.8kJ/mol ①实验装置保温、隔热效果差。②用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度。分多次把NaOH溶液倒入盛有硫酸的小烧杯中。量取NaOH溶液的体积时仰视读数。
-1560kJ·mol-1 少 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1 乙烷 保温隔热,减少热量的散失 A 用套在温度计上的环形玻璃棒上下搅动 3.4 -56.8kJ/mol ①实验装置保温、隔热效果差。②用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度。分多次把NaOH溶液倒入盛有硫酸的小烧杯中。量取NaOH溶液的体积时仰视读数。
【解析】
Ⅰ.(1)依据原子守恒分析可知氢原子守恒,6a=2,a=![]() ;
;
(2)依据原子守恒分析可知氢原子守恒,6a=2,a=![]() ,则根据图象分析可知
,则根据图象分析可知![]() mol乙烷完全燃烧放热520kJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560kJ,则乙烷的燃烧热△H=-1560 kJ·mol-1,故答案为-1560 kJ·mol-1;
mol乙烷完全燃烧放热520kJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560kJ,则乙烷的燃烧热△H=-1560 kJ·mol-1,故答案为-1560 kJ·mol-1;
(3)因为液态乙烷转化为气态乙烷要吸热,所以等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量少,故答案为少;
(4)根据图象分析可知![]() mol二甲醚完全燃烧放热485kJ,则1mol二甲醚完全燃烧放热=485kJ×3=1455kJ,反应的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1,故答案为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1;
mol二甲醚完全燃烧放热485kJ,则1mol二甲醚完全燃烧放热=485kJ×3=1455kJ,反应的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1,故答案为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1;
(5)根据图象可知,消耗相同物质的量的乙烷和二甲醚生成的二氧化碳相同,但放出的热量乙烷多,所以放出相同的热量时,选择乙烷作为燃料产生的CO2较少,故答案为乙烷;
Ⅱ.(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温隔热、减少实验过程中的热量散失;
(2)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选A;
(3)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,可以使硫酸与 NaOH 溶液混合均匀;
(4)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为3.4℃;
②50mL 0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100mL×1g/mL=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=![]() =-56.8kJ/mol;故答案为-56.8kJ/mol;
=-56.8kJ/mol;故答案为-56.8kJ/mol;
③装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小;量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大;NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小;温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小;以上操作,写两条即可。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】已如:通常羟基与碳碳双键相连时不稳定,易发生下列变化: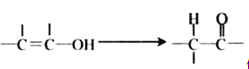 依据如下图所示的转化关系,回答问题:
依据如下图所示的转化关系,回答问题:
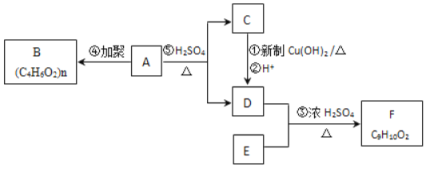
(1)A的化学式是____________________;
(2)B的结构简式是____________________;
(3)①的化学方程式是____________________________________________________________;
(4)F是芳香族化合物且苯环上只有一个侧链,写出F的结构简式____________________________________________________________________。
(5)G是F的同分异构体,有关G的描述;①能发生水解;②苯环上有三个取代基;③苯环上一溴代物有2种,据此推测G的结构简式可能是(写出其中一种)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3种元素的基态原子的电子排布式如下:①![]() ,②
,②![]() ,③
,③![]() 。则下列有关比较中正确的是
。则下列有关比较中正确的是
A.第一电离能:③>②>①B.原子半径:①>②>③
C.电负性:③>②>①D.最高正化合价:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧ag液态乙醇生成二氧化碳气体和液态水,放出QkJ热量,经测定ag液态乙醇与足量钠 反应生成标准状况下5.6L氢气。则液态乙醇燃烧的热化学方程式表示正确的是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-QkJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-2QkJ·mol-1
C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=+QkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯与氯化氢可能发生的两种加成反应及相应的能量变化与反应过程如下图所示,下列说法错误的是( )


A.活化能:反应①大于反应②
B.中间产物的稳定性:中间体1小于中间体2
C.产物的能量:产物1大于产物2
D.△H大小:反应①小于反应②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,不能达到实验目的是( )
A. 图1:实验室制备Fe(OH)2
图1:实验室制备Fe(OH)2
B.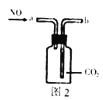 图2:收集NO气体
图2:收集NO气体
C. 图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
D. 图4:可证明NH4NO3溶解时需要吸收热量
图4:可证明NH4NO3溶解时需要吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:

已知:R-CHO+(CH3CO)2O![]() R-CH=CHCOOH+CH3COOH
R-CH=CHCOOH+CH3COOH
(1)A的分子式为_________,C中的官能团名称为_____________。
(2)D分子中最多有________________个原子共平面。
(3)E生成F的反应类型为________________,G的结构简式为________________。
(4)由H生成I的化学方程式为:______________。
(5)符合下列条件的B的同分异构体有多种,其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是(写出其中一种的结构简式) ________________。
①属于芳香化合物;②能发生银镜反应
(6)己知RCOOH![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备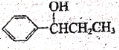 的合成路线。
的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 分子固体中只存在分子间作用力,不含有其它化学键
B. 形成共价键的元素一定是非金属元素
C. 共价键的饱和性与原子轨道的重叠程度有关
D. σ 键可以单独形成且可以绕键轴旋转,π 键不行
查看答案和解析>>
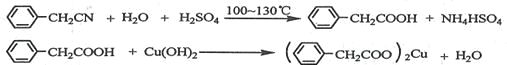
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
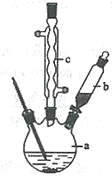
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com