
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。

P4分子结构模型
A.常温常压下,16 g14CH4中所含的中子数为8NA
B.标准状况下,22.4 L CCl4中所含的分子数为NA
C.在1 L 1.0 mol·L-1 NaCl溶液中含有NA个NaCl分子
D.6.2 g白磷(分子式为P4,分子结构如图所示)中所含的P—P键数目为0.3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.3核素练习卷(解析版) 题型:填空题
(1)A元素原子的核电荷数为8,其原子核内的质子数为________,该元素原子的二价阴离子中,核外电子数为________,中子数是9的核素表示为________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
(3)A、B形成1∶1型化合物的相对分子质量是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略):

(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示):
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是 ;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:实验题
草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:

(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:

步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。

下列叙述错误的是( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
下列有关化学用语正确的是( )。
A.核内有8个中子的碳原子:
B.CS2的结构式:S—C—S
C.乙烯的比例模型: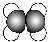
D.NH4Br的电子式:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下:


回答下列问题:
(1)B→C的反应类型为_____________________________。
(2)A→B反应的化学方程式为______________________________________
__________________________________。
从整个合成路线看,步骤A→B的目的是_______________________________。
(3)E的结构简式为____________________________。
(4)A在一定条件下可生成
F( )。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
)。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
①属于芳香族化合物;②是一种α?氨基酸;③分子中有6种不同化学环境的氢。
(5)非那西汀是一种解热药,其结构简式为 ,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:
,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com