
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
分析 (1)可以选择硫氰酸钾来检验三价铁离子,高锰酸根离子具有氧化性,可以将还原性的离子亚铁离子氧化;
(2)根据NO2与Na2S溶液反应的现象知识来回答;
(3)NO2与水反应也能生成NO和硝酸;
(4)丙中的现象不足以证明NO存在,NO2会存在干扰;
(5)可以根据化学方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O进行相应的计算.
解答 解:(1)可以选择硫氰酸钾来检验三价铁离子,存在三价铁离子时,溶液变红色,亚铁离子具有还原性,可以被高锰酸钾氧化为三价铁离子,导致高锰酸钾褪色,故答案为:
| 步骤 | 操作 | 现象与结论 | 可能的离子方程式 |
| 第1步 | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 | |
| 第2步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
点评 本题是一道实验探究题目,考查学生分析和解决问题的能力,考查角度广,难度大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
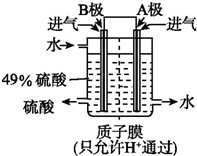 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
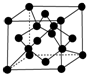 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
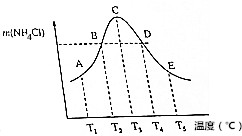 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 电子层数和次外层电子数 | D. | 相对原子质量和最外层电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com