
| A. | 空气 | B. | 氨水 | C. | 矿泉水 | D. | 蒸馏水 |
科目:高中化学 来源: 题型:解答题
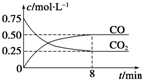 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
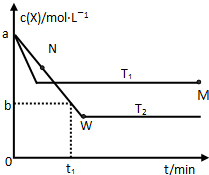 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是吸热反应 | |
| B. | 生成物的总能量低于反应物的总能量 | |
| C. | 导致醋酸凝固的原因:该反应吸热使大烧杯中的热能转化为小烧杯中产物的内能 | |
| D. | 该反应的热化学方程式为:NH4HCO3(s)+HCl(aq)=NH4Cl(aq)+CO2(g)+H2O(l)△H=+Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com