
| A、37.5mL |
| B、75mL |
| C、150mL |
| D、300mL |
| 1.200g |
| 16g/mol |
| 0.15mol |
| 1mol/L |


科目:高中化学 来源: 题型:
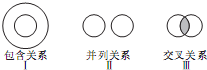
| A、烃与烷烃属于I |
| B、电解质与非电解质属于Ⅱ |
| C、离子反应与氧化还原反应属于Ⅲ |
| D、酸性氧化物与非金属氧化物属于I |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA(相对原子质量 Cu:64) |
| C、1L 1.0mol?L-1NH4Cl与2L 0.5mol?L-1NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、电池放电时,电池负极周围的溶液pH不断增大 |
| B、电池放电时,镍元素被氧化 |
| C、电池放电时,镍元素被还原 |
| D、电池放电时,H2是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
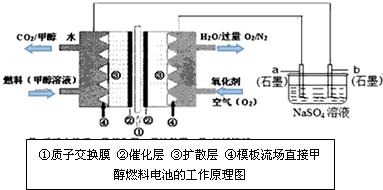
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 |
| 元素 | E | F | G | H |
| 原子半径(nm) | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、①②③⑤ |
| C、④⑤ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com