
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。
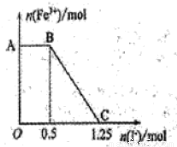
则下列有关说法错误的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
D
【解析】
试题分析:高锰酸钾的氧化性大于铁离子,铁离子大于碘。A、AB段铁离子的物质的量不变,说明此时高锰酸钾与碘离子发生氧化还原反应,正确;B、BC段铁离子的物质的量逐渐减少至0,说明该段发生的是铁离子与碘离子的氧化还原反应,离子方程式是2Fe3++2I-= 2Fe2++ I2,正确;C、根据以上分析,高锰酸钾先氧化亚铁离子,剩余的再氧化碘离子,铁离子氧化碘离子,所以相当于高锰酸钾直接与碘离子发生氧化反应,共消耗1.25molI-。碘离子的物质的量是1.25mol,则失去电子的物质的量是1.25mol,高锰酸钾氧化碘离子为单质碘,自身被还原为+2价锰离子,根据得失电子守恒,所以用于与碘离子反应的高锰酸钾的物质的量是1.25mol/5=0.25mol,正确;D、由图像可知铁离子消耗碘离子的物质的量是1.25-0.5=0.75mol,根据2Fe3++2I-= 2Fe2++ I2,所以亚铁离子的物质的量是0.75mol,则硫酸亚铁的物质的量是0.75mol,错误,答案选D。
考点:考查物质氧化性的应用,对图像的分析与计算


 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
实验室里需用950mL 0.1 mol/L的硫酸铜溶液时,下列操作正确的是
A.称取15.2g硫酸铜固体,加入1000 mL水
B.称取24g胆矾溶于水配成1000 mL溶液
C.称取16 g硫酸铜固体,加入1000 mL水
D.称取25 g胆矾溶于水配成1000 mL溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(10分)K2EO4(E代表某种元素)在工业上有重要的应用,以下是制备该物质的工艺流程图:
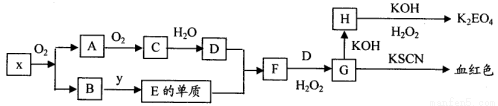
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是 ,H的化学式是 。
(2)写出F→G的离子反应方程式 。
(3)要工业上实现B→E的转化,y的化学式可能是 。
(4)1molH转化为K2EO4时需H2O2的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol·L-1AgNO3溶液:H+、K+、SO42-、I-
D.0.1 mol·L-1NaAlO2溶液: K+、Na+、ClO-、S2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
[化学——选修三:物质结构与性质](15分)
2011年3月11日日本发生了9.0级强地震。福岛第一核电站1号机组12日下午发生氢气爆炸。随后在爆炸核电站周围检测到的放射性物质有碘-131和铯—137,碘-131一旦被人体吸入,可能会引发甲状腺疾病。日本政府计划向核电站附近居民发放防止碘-131辐射的药物碘片。
(1)Cs(铯)的最外层电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素A、B、C的电离能如下表:

那么三种元素C的元素符号为____________,形成其单质晶体的化学键类型__________。
(2)F、Cl、Br与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别是________、________。与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物,非金属氯化物等。BCl3是一种非金属氯化物,该物质分子中B—Cl键的键角为________。基态溴原子的简化电子排布式为 _____ 。
(3)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为_______ __。
(4)测定气态氟化氢分子量总大于20,你认为可能的原因为 。
(5)碘—131是碘单质,其晶胞结构如下图甲所示,该晶胞中含有________个I2分子;KI的晶胞结构如下图乙所示,每个K+紧邻________个I-。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
有三种不同的集团,分别为-X、-Y、-Z,若同时分别取代苯环上的三个氢原子,能生成的同分异构体数目是
A.4种 B.6种 C.8种 D.10种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2S
A.③④ B.②③④ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(9分)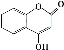 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:

请回答:
(1)B→C的反应类型是______ ______。D中所含的官能团名称是 。
(2)下列关于化合物G的说法不正确的是__ ___。
a.分子式是C9H6O3
b.不能与金属钠反应
c.分子中含有4种官能团
d.能与液溴反应
e.1 mol G最多能和4mol氢气反应
(3)写出A与银氨溶液反应的化学方程式 。
(4)写出D→E的化学方程式__________________ ___________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下)
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com