
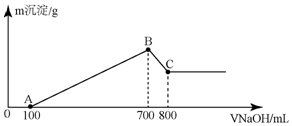
 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:分析 由图象可知,OA段没有沉淀生成,说明发生反应:H++OH-=H2O,根据n=cV可计算出与HCl反应的NaOH的物质的量,然后根据n(NaOH)=n(HCl)计算出溶解合金后过量的氯化氢物质的量;
AB段:加入NaOH溶液100mL~700mL时发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;
BC段:加入NaOH 700~800mL时发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH溶液100mL,消耗的n(NaOH)=0.1L×2mol/L=0.2mol,以此可计算Al3+的物质的量,根据结合反应的离子方程式计算铝的质量;当加入NaOH700mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,以此计算盐酸的物质的量浓度.
解答 解:AB段:加入NaOH溶液100mL~700mL时发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;BC段:加入NaOH 800mL时发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH溶液100mL,
(1)由图象可知,OA段没有沉淀生成,说明发生反应:H++OH-=H2O,与HCl反应的NaOH的物质的量为:2mol/L×0.1L=0.2mol,根据n(NaOH)=n(HCl)计算出溶解合金后过量的氯化氢物质的量为0.2mol,
故答案为:0.2mol;
(2)加入800mL溶液时,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,消耗了100mLNaOH溶液,则:n(NaAlO2)=n(NaOH)=0.1L×2mol/L=0.2mol,
根据质量守恒可知:n(Al3+)=n(Al(OH)3)=0.2mol,
所以合金中铝的质量为:m(Al)=0.2mol×27g/mol=5.4g;
故答案为:5.4g;
(3)由图象可知,当加入NaOH700mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,则n(NaCl)=n(NaOH)=0.7L×2moL/L=1.4mol,
则原来盐酸的物质的量浓度为:c(HCl)=$\frac{1.4mol}{0.5L}$=2.8mol/L,
故答案为:2.8mol/L.
点评 本题以图象题的形式考查镁铝化合物性质、混合物的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意利用守恒思想进行计算.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | Na2CO3溶液 | ||
| C. | 石蕊试液 | D. | 新制的Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述 I | 陈述 II | 判断 | |
| A | SO2可使酸性高锰酸钾溶液腿色 | 因为SO2具有漂白性 | I对,II对,有 |
| B | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝不能与浓硝酸或浓硝酸反应 | I对,II对,无 |
| C | 铝箔在酒精灯火焰上,加热后熔化但液态铝不滴落 | 因为铝在空气中氧化生成一层薄薄的致密氧化膜,熔点高,而金属铝的熔点较低 | I对,II对,有 |
| D | 高压钠灯发出透雾性强的黄光 | 因为金属钠具有强还原性 | I对,II对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )| X | Y | Z | |
| A | SO2 | CO | CaCl2 |
| B | NH3 | CO2 | Al2(SO4)3 |
| C | NO2 | SO2 | BaCl2 |
| D | Cl2 | O2 | Na2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2和HCl | B. | NaOH和NaHCO3 | C. | CO2和NaOH | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com