
| A、金属钠投入蒸馏水2Na+2H2O=2Na++20H-+H2↑ |
| B、向亚硫酸钠溶液中加入足量硝酸S032-+2H+=S02↑+H2O |
| C、用浓盐酸与Mn02反应制取少量氯气Mn02+4H++2Cl-=Mn2++2H2O+Cl2↑ |
| D、硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H202=Fe3++2H2O |
| ||


科目:高中化学 来源: 题型:
| A、纯碱溶液中加入浓盐酸 |
| B、小苏打溶液中加人稀硫酸 |
| C、石灰石溶于稀硝酸 |
| D、碳酸钾溶液中加入醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、l.0mol?L-1 NaClO溶液:Fe2+、K+、I-、Cl- | ||
| C、甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | ||
D、在
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀H2SO4吸收氨气:NH3+H+═NH4+ |
| B、少量的CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O |
| C、铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D、足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等压时,通入惰性气体,C的物质的量增大 |
| B、等压时,通入X气体,反应器中温度不变 |
| C、等容时,通入惰性气体,各反应速率不变 |
| D、等容时,通入X气体,Y的物质的量浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
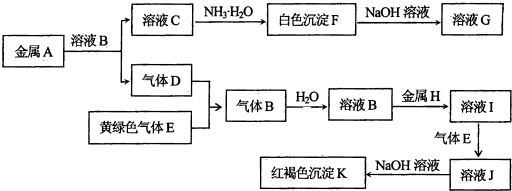
查看答案和解析>>
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ |
1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图l用于制取纯净的NO2气体 |
| B、图2用于研究温度对化学平衡的影响 |
| C、图3用于实验室Cl2的收集 |
| D、图4用于除去CO2气体中的HCl杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com