
| A. | 热的纯碱溶液去油污效果比冷的纯碱溶液去油污效果好 | |
| B. | 加热稀醋酸溶液其pH 稍有减小 | |
| C. | 实验室制FeCl3溶液时,把FeCl3固体溶于浓盐酸中,再加水稀释到所需的浓度 | |
| D. | 草木灰与铵态氮肥不能混合使用 |
分析 A、纯碱水解呈碱性,为可逆过程,加热促进水解;
B.醋酸为弱酸,存在电离;
C.水解呈酸性,加酸抑制水解;
D.碳酸钾溶液中碳酸根离子水解显碱性,铵盐溶液中铵根离子水解溶液显酸性,混合后二者水解相互促进.
解答 解:A、纯碱水解呈碱性,为可逆过程,加热促进水解,且酯的水解为可逆过程,存在RCOOR'+H2O?RCOOH+R'OH,在强碱存在的条件下,ROOH与碱反应,有利于平衡向正反应方向移动,所以热的纯碱溶液去油污效果好,与水解有关,故A不符合;
B.醋酸为弱酸,加热促进弱酸的电离,与盐类的水解无关,故B符合;
C.FeCl3水解生成氢氧化铁沉淀常导致溶液变浑浊,同时溶液呈酸性,加入酸可抑制水解,与盐类水解有关,故C不符合;
D.草木灰中的碳酸根离子水解显碱性,铵态氮肥中铵根离子水解显酸性,二者相互促进,与水解有关,故D不符合;
故选B.
点评 本题考查盐类水解的原理及应用,题目难度不大,注意盐类水解的原理以及影响因素.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 | |
| B. | 根据溶液的pH与溶液酸碱性的关系,推出pH=7.0的溶液一定显中性 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HC1、HBr、HI的还原性依次增强 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,因此NH3沸点低于PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.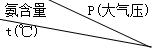 | 100 | 200 | 300 | 600 | 1000 |
| 200 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “面粉增白剂”中的过氧化钙(CaO2)属于氧化物 | |
| B. | “苏打水”中的碳酸氢钠,制作“毒豆芽”所用的亚硝酸钠都属于钠盐 | |
| C. | 35Cl和37Cl互称为同位素,红磷、白磷互为同素异形体 | |
| D. | “碘片”和“加碘盐”都属于混合物,其中“碘”是单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
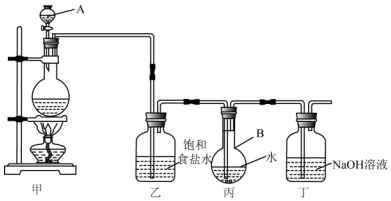
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解法冶炼钠、镁、铝等活泼金属 | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,该电极反应式为Cu2++2e-=Cu | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 | |
| D. | 反应SO2(g)+2H2S(g)=3S (s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将1 g铝片投入20 mL 18.4 mol•L-1的硫酸中 | |
| B. | 用50 mL浓盐酸与足量MnO2共热 | |
| C. | 向100 mL 3 moI•L-1的硝酸中加入5.6 g铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com