
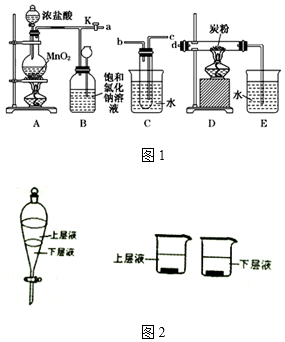
分析 (1)试管中盛有水,气体通过盛有水的试管时应采用长进短出的方式;
(2)根据题干信息判断反应物和生成物,然后结合质量守恒定律书写化学方程式;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)应用相似相溶原理,结合萃取操作方法进行解答.
解答 解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,
故答案为:c;b;
(2)由题意知C为提供水蒸气的装置,加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,
故答案为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升;氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)应用相似相溶原理,氯气在CCl4中溶解度较大,而且四氯化碳的密度比水大,呈黄绿色的是溶有氯气的下层四氯化碳层,能使有色布条褪色,氯气在无机层与接触发生化学反应生成次氯酸,而导致有色布条褪色的,
故答案是:上层液.
点评 本题考查氯气的制备、氯气的化学性质,题目难度中等,涉及萃取的操作方法、次氯酸的漂白原理和防倒吸的相关知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.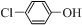 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用NaOH和湿润的红色的石蕊试纸检验NH4+ | |
| B. | 该方法会导致水体pH下降 | |
| C. | 该方法中O2做氧化剂,微生物做还原剂 | |
| D. | 处理后的废水需进一步处理才能排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com