
| A. | 17.4g | B. | 46.8g | C. | 40.8g | D. | 23.4g |
分析 有一块镁铝合金,其中镁与铝的质量比是8:9,则物质的量之比为$\frac{8}{24}$:$\frac{9}{27}$=1:1,加入足量稀HNO3使其完全溶解后,根据n=$\frac{V}{{V}_{m}}$计算NO物质的量,根据电子转移守恒计算Mg、Al物质的量,溶液中再加入NaOH溶液,生成沉淀质量的最大,沉淀为Mg(OH)2、Al(OH)3,根据Mg元素守恒n[Mg(OH)2]=n(Mg),根据Al元素守恒n[Al(OH)3]=n(Al),再根据m=nM计算沉淀质量.
解答 解:有一块镁铝合金,其中镁与铝的质量比是8:9,则物质的量之比为$\frac{8}{24}$:$\frac{9}{27}$=1:1,加入足量稀HNO3使其完全溶解后,生成NO物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,根据电子转移守恒,n(Mg)=n(Al)=$\frac{0.5mol×3}{2+3}$=0.3mol,溶液中再加入NaOH溶液,生成沉淀质量的最大,沉淀为Mg(OH)2、Al(OH)3,根据Mg元素守恒n[Mg(OH)2]=n(Mg)=0.3mol,根据Al元素守恒n[Al(OH)3]=n(Al)=0.3mol,故沉淀最大质量为:0.3mol×58g/mol+0.3mol×78g/mol=40.8g,
故选:C.
点评 本题考查混合物计算,关键是根据电子转移守恒计算金属物质的量,较好的考查学生分析计算能力,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | Fe是正极,Pt是负极 | B. | 该装置中,电子从Fe流向Pt | ||
| C. | 正极反应为:2H++2e-═H2↑ | D. | 负极反应为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C气体的体积分数增大 | B. | 平衡向逆反方向移动 | ||
| C. | 气体A的转化率升高 | D. | m+n>p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

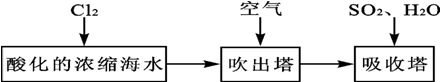

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com