
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
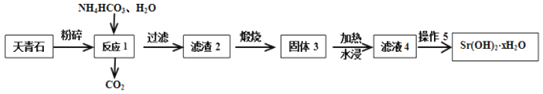
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
【答案】-1 强 5.00×10-10 27SrO+16Al![]() 3SrO8Al2O3+24Sr SrSO4+2NH4HCO3=SrCO3↓+H2O+CO2↑+(NH4)2SO4 过滤分离 减慢冷却结晶的速度
3SrO8Al2O3+24Sr SrSO4+2NH4HCO3=SrCO3↓+H2O+CO2↑+(NH4)2SO4 过滤分离 减慢冷却结晶的速度 ![]()
【解析】
天青石(主要成分SrSO4)粉碎后与NH4HCO3混合加热,发生反应有(NH4)2SO4和CO2、SrCO3,然后过滤,在滤渣中含有SrCO3,将其煅烧,反应产生SrO,SrO与水反应产生Sr(OH)2x H2O。据此解答。
I.(1)Sr的化合价为+2,SrO2中氧元素的化合价为-1;25℃时,饱和Sr(OH)2溶液的浓度大于Mg(OH)2的浓度,即Sr(OH)2溶液电离程度大、碱性强;25℃时Mg(OH)2的溶度积Ksp=c(Mg2+)×c2(OH-)=5.00×10-4×(2×5.00×10-4)2=5.00×10-10;
(2)SrO与铝粉加热反应生成金属锶和3SrO8Al2O3,反应的化学方程式为27SrO+16Al![]() 3SrO8Al2O3+24Sr;
3SrO8Al2O3+24Sr;
II.(3)滤渣2混有SrCO3,则SrSO4和NH4HCO3反应生成SrCO3的化学方程式为SrSO4+2NH4HCO3=SrCO3↓+H2O+CO2↑+(NH4)2SO4;
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2溶液,缓慢加热有利于沉淀颗粒长大,便于过滤分离;
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤等。所以要得到较大颗粒的Sr(OH)2xH2O晶体,可减慢冷却结晶的速度;
(6)将m g纯净Sr(OH)2·xH2O产品溶于水,加入过量纯碱溶液,发生反应产生SrCO3、NaOH,由Sr原子守恒得到关系式:Sr(OH)2xH2O~SrCO3,根据二者反应关系式可知:每(122+18x)份Sr(OH)2xH2O反应会产生88份SrCO3,则m g Sr(OH)2xH2O反应产生SrCO3的质量为m(SrCO3)=![]() ×m g=n g,解得x=
×m g=n g,解得x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某气体X可能由氢气、一氧化碳、甲烷中的一种或几种组成,将X燃烧,把燃烧后生成的气体通过如图所示的A、B两个洗气瓶,试回答:
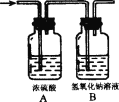
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则X气体是(填化学式,下同).________。
(2)若A、B两个洗气瓶的质量都增加,则X气体可能的组合是(每空填一种组合):①________, ②________,③________,④________, ⑤________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A.pH相等的两溶液:c(CH3COO-)=c(Cl-)
B.等浓度的盐酸和醋酸中和相同物质的量的NaOH时,盐酸的体积小
C.同pH值时,稀释相同倍数后,醋酸溶液的pH值大
D.等pH值的盐酸和醋酸与铁粉反应,产生气体的速率盐酸快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用FeS作为沉淀剂除去工业废水中的Pb2+,反应原理为FeS(s)+Pb2+(aq) ![]() PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
A.达到平衡时,c(Pb2+)=c(Fe2+)
B.Ksp(FeS)大于Ksp(PbS)
C.该反应的平衡常数K=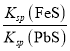
D.溶液中加入少量Na2S固体后,c(Fe2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前“低碳减排”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。

(1)汽车尾气净化的主要原理为![]() 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时,![]() 随温度
随温度![]() 、催化剂表面积
、催化剂表面积![]() 和时间
和时间![]() 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
②在![]() 温度下,
温度下,![]() 内的平均反应速率
内的平均反应速率![]() ______
______![]() 。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积![]() ,在答题卡相应图中画出
,在答题卡相应图中画出![]() 在
在![]() 、
、![]() 条件下达到平衡过程中的变化曲线_____。
条件下达到平衡过程中的变化曲线_____。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到![]() 时刻达到平衡状态的是______
时刻达到平衡状态的是______![]() 填代号
填代号![]() 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如:![]()
![]()
写出![]() 催化还原
催化还原![]() 生成
生成![]() 、
、![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。催化剂b表面发生的电极反应为______
的原理示意图。催化剂b表面发生的电极反应为______
③常温下![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______
______![]() 填写最终计算结果
填写最终计算结果![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与钙和钡属于第ⅡA族元素。
(1)碱性:Sr(OH)2___Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是___。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3。
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.0 | 3.4 |
完全沉淀的pH | 3.2 | 9.0 | 4.7 |
①步骤Ⅰ中,反应的化学方程式是______。为提高此步骤中锶的转化效果可以采取的措施有(任答两点即可):______。
②步骤Ⅱ中,能与盐酸反应而溶解的物质有______。
③步骤Ⅳ的目的是_______。
④下列关于该工艺流程的说法正确的是________(填字母代号)。
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
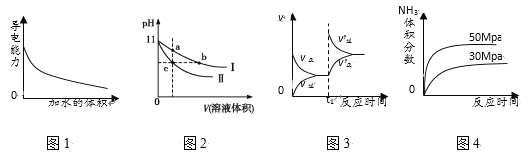
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

A. 水的电离程度:b>c>a
B. 若分别用等浓度的NaOH溶液完全中和,消耗NaOH的体积:b>a>c
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:a>b>c
D. 溶液中离子总浓度: a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com