
| A、78g 苯含有C=C双键的数目为3NA |
| B、常室温下,1LpH=13的Ba(OH)溶液中,溶液中的OH-离子数目为0.2NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子 |


科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、X、Y、M的单质分别与水反应,Y最剧烈 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、Y的氧化物水化物的酸性一定强于R的氧化物水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
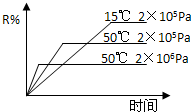 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用A表示的反应速率是0.8 mol?L-1?s-1 |
| B、分别用B、C、D表示反应的速率,其比值是3:2:1 |
| C、在2 min末时的反应速率,用反应物B来表示是0.3 mol?L-1?min-1 |
| D、在这2 min内用B和C表示的反应速率的值都是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、40% |
| C、50% | D、60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g O2所含的原子数目为NA |
| B、1mol Na2SO4溶于水中,所得溶液中Na+个数为2NA |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5 NA个氧气分子的物质的量是0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com