
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=2的溶液:Na+、Fe2+、I-、NO3-
B.c(AlO2-)=0.1 mol·L-1的溶液:K+、Na+、OH-、SO42-
C.![]() =0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
=0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Mg2+、NH4+、Cl-、SCN-
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白
(1)写出Na2O2的电子式_____
(2)Al(OH)3在碱性溶液中的电离方程式为_____
(3)用离子方程式表示Na2S溶液呈碱性的原因_____
(4)在锌粒与稀硫酸的反应体系中,若滴加几滴CuSO4溶液,发现放出气体的速率明显加快,说明其原因:_____;若加入少量醋酸钠固体,发现放出气体的速率明显减慢,说明其原因_____。
(5)用惰性电极电解U形管中的饱和食盐水(已滴加酚酞),_____极附近溶液会变红。写出用惰性电极电解氯化铜溶液的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.《抱朴子》中“丹砂烧之成水银,积变又还成丹砂”两个反应互为可逆反应
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阴极的阳极保护法
C.门捷列夫根据元素的性质随着相对原子质量递增呈现周期性变化规律,制出了第一张元素周期表
D.石灰乳与海水混合,过滤得![]() ,将其溶于盐酸,再蒸发结晶得到
,将其溶于盐酸,再蒸发结晶得到![]() ,电解熔融
,电解熔融![]() 可得到金属镁
可得到金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为_____________________。又已知:![]() ,则氨气在空气中燃烧生成液态水和氮气时的热化学方程式为______________________。
,则氨气在空气中燃烧生成液态水和氮气时的热化学方程式为______________________。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变![]() 和
和![]() 的量),反应速率与时间的关系如图所示。
的量),反应速率与时间的关系如图所示。
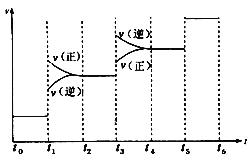
图中t1时引起平衡移动的条件可能是_______________,其中表示平衡混合物中NH3的含量最高的一段时间是______________。
②氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如![]() 等。对于反应:
等。对于反应:![]() ,在温度为
,在温度为![]() 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
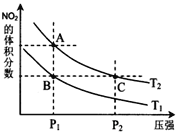
下列说法正确的是______。
a.![]() 两点的化学平衡常数:
两点的化学平衡常数:![]()
b.![]() 两点的气体颜色:
两点的气体颜色:![]() 浅,
浅,![]() 深
深
c.![]() 两点的气体平均相对分子质量:
两点的气体平均相对分子质量:![]()
d.![]() 两点的反应速率:
两点的反应速率:![]()
e.由状态B到状态A,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
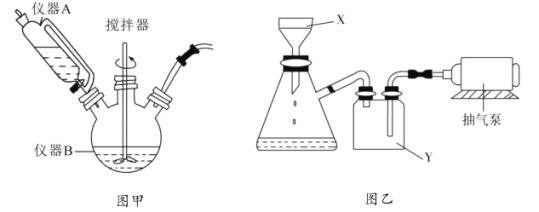
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
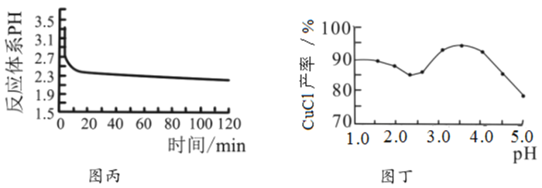
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物转化题。A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
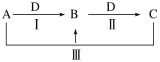
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________,B的俗名____________;
②反应Ⅱ的离子方程式是_____________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅱ的离子方程式是____________;
②反应Ⅲ的离子方程式表示反应__________;
③检验B中阳离子最好的试剂是_________(写化学式)。
(3)C与NaOH溶液反应,用离子方程式表示产生此现象的过程________、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+)
B.氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-)
C.氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
D.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
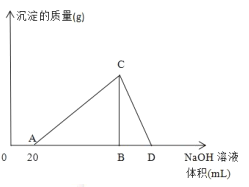
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的
的![]() 溶液中逐滴滴加
溶液中逐滴滴加![]() 的
的![]() 溶液。溶液
溶液。溶液![]() 随滴入
随滴入![]() 溶液体积变化如图所示。下列说法正确的是( )
溶液体积变化如图所示。下列说法正确的是( )
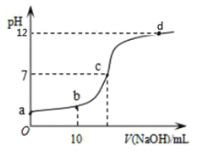
A.![]() 点的
点的![]()
B.![]() 点时,
点时,![]()
C.![]() 点时,
点时,![]()
D.从a→d,水的电离度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com