
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,1个O22+中含有2个π键.
,1个O22+中含有2个π键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
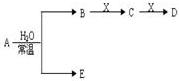 已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去).
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
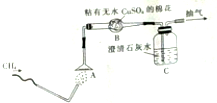 为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
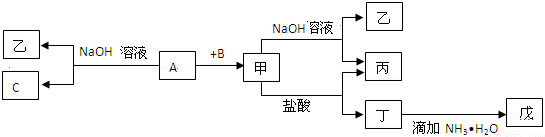
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
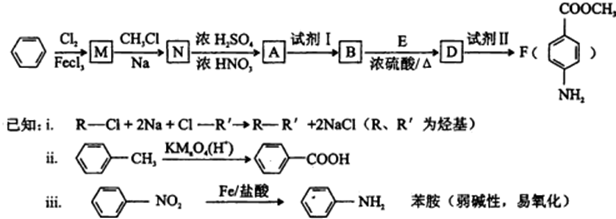
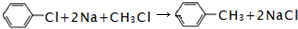 .
.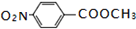 .
. ;
;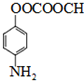 .
.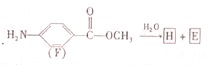
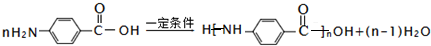 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、蛋白质、油脂都是营养物质,都属于高分子化合物,都能发生水解反应 | |
| B. | 人造纤维、合成纤维、碳纤维、光导纤维主要成分都是纤维素 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物的化学式为As2O5 | |
| B. | 气态氢化物的稳定性强于磷化氢而弱于硫化氢 | |
| C. | 砷单质在通常状况下为固态 | |
| D. | 砷酸是一种弱酸,酸性比磷酸酸性弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com