
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |
| 1 |
| 22.4 |
| 1 |
| 22.4 |
| ||
| 5V |
| 1 |
| 22.4 |
| 1 |
| 2 |
| ||
| 2.5V |
| 1 |
| 22.4 |
| 4 |
| 1 |
| 4V |
| 22.4 |
| ||
| 5V |
| 0.8V |
| 22.4 |
| 1 |
| 22.4 |
| 1 |
| 22.4 |
| 0.8V |
| 22.4 |


科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、(a+b)>(c+d) |
| C、Z的物质的量变小 |
| D、X的转化率变小. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol-1,则H2的燃烧热为241.8 kJ?mol-1 |
| B、若C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
| C、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ?mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
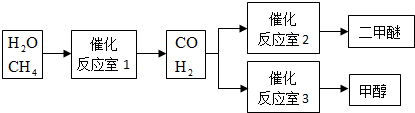
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 起始浓度c/mol?dm3 | 平衡浓度c/mol?dm3 | K | 温度T | ||||
| H2 | N2 | NH3 | H2 | N2 | NH3 | |||
| 实验1 | 1.9868 | 1.356 | 0 | 1.35 | 1.15 | 0.412 | 5.98×10-2 | T1 |
| 实验2 | 0.6405 | 1.0435 | 0 | C1 | C2 | C3 | K2 | T1 |
| 实验3 | 0.6405 | 1.0435 | 0 | 0.51 | 1.00 | 0.087 | 6.05×10-2 | T2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
| B、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O |
| C、5.6克Fe与200ml 2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
| D、足量的SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2=CaSO4+2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com