
有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4 mol/L,SO42-的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为 ( )
A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年贵州省遵义市高三第二次联考理综化学试卷(解析版) 题型:填空题
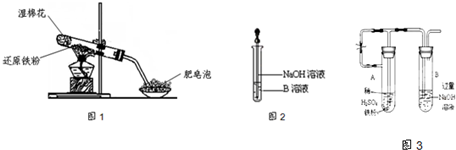
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
A.酸性KMnO4溶液??? B.含有盐酸的KSCN溶液??? C.碘水??? D.次氯酸钠溶液
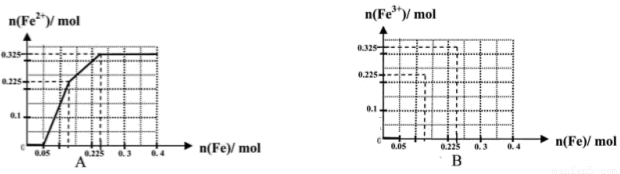
(二)(5分)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
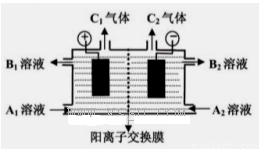
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式???????????????????????????????? .
(3)请简述阴极室能流出NaOH的浓溶液的原因????????????????????????? .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com