
 CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
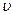 正(H2)=
正(H2)=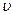 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:| 时间(min ) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |


科目:高中化学 来源:不详 题型:填空题
 3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
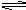 H++HSO4- HSO4-
H++HSO4- HSO4-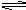 H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:  和
和 在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。 的化学方程式
的化学方程式 ,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是
,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是  的体积比的取值范围是
的体积比的取值范围是  ,以n表示
,以n表示 和
和 的物质的量之比,a表示
的物质的量之比,a表示 的转化率,x表示达到反应限度时混合物中
的转化率,x表示达到反应限度时混合物中 的体积分数,则
的体积分数,则 、a、x的关系式为 。
、a、x的关系式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )
mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是( )| A.n="1,m=1" | B.n="3,m=3" | C.n="2,m=3" | D.n=3,m=2. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCO3-+OH-。下列说法中,正确的是( )
HCO3-+OH-。下列说法中,正确的是( )
A.升高温度,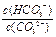 减小 减小 |
B.通入CO2,平衡向正反应方向移动 |
| C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com