
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
分析 SO2、CO2都能和澄清石灰水反应生成不溶性白色固体,但二氧化硫具有漂白性、还原性,二氧化碳没有漂白性.
解答 解:A.先通过足量澄清石灰水,二者均反应,不能检验二氧化碳,故A不选;
B.先通过足量饱和NaHCO3溶液,二氧化硫与碳酸氢钠反应生成二氧化碳,不能检验原二氧化碳,故B不选;
C.先通过足量NaOH溶液,二者均反应,不能检验,故C不选;
D.先通过足量酸性KMnO4溶液,除去二氧化硫,再通过澄清石灰水,观察是否变浑浊可检验二氧化碳,故D选;
故选D.
点评 本题考查物质的检验及鉴别,为高频考点,把握物质的性质、性质差异及发生的反应是解答本题的关键,侧重分析与应用能力的考查,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
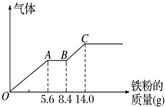 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
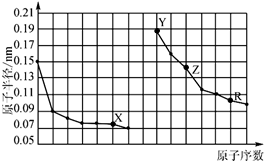
| A. | X、R的最高化合价相同 | |
| B. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| C. | X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1 | |
| D. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4既是氧化产物又是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 当转移电子数目为0.2NA时,气体体积增大1.12L | |
| D. | 当有26g固体参加反应时,转移电子数目为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
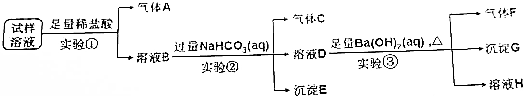
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com