
【题目】海水中含有大量的化学元素,自然界中的有些元素主要存在于海水中。下列元素中, 被称为“海洋元素”的是( )
A.氮B.硫C.溴D.氯
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业会产生含氨氟酸的废水。完成下列填空:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00 mL废水,滴入2~3滴酚酞试液,用0.0100 mol/L标准NaOH溶液滴定,用去26.00 mL。滴定终点的判断方法是_______________________。废水中的c(HF) =_________mol/L。 (精确到 0.0001)
(2)工业上用石灰乳处理含氢氟酸的废水,处理时要控制反应池中呈碱性,目的是_______。
(3)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4),含氟底泥可用于制取氟化钙,其生产流程如下:

已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3,试从平衡移动的角度分析,沉淀能够转化的原理。____________________________________________________________。
②酸洗是为了除去CaCO3,酸洗时发生反应的离子方程式为______________________。
③最终得到的产品质量比底泥中CaF2的质量__________ (填“多"、“少”或“相等”),理由是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
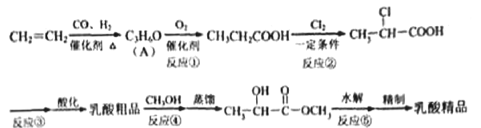
完成下列填空:
(1) 乳酸中的官能团名称是___________ 。A 的结构简式是___________。
(2)反应②的反应类型是___________。反应③的条件是___________。
(3)反应④的化学方程式为____________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:

聚乳酸降解时,会产生自催化效应(降解的速度会越来越快) ,请解释原因__________。
(5)设计一条由丙烯制备丙酸的合成路线 _____________________ 。
(合成路线常用的表示方式为:A ![]() B ... ...
B ... ... ![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中,所发生的反应方程式为______________________________________。与电源_______极相连的电极附近溶液滴入酚酞显红色。阳极产物是______________,实验室用__________________________检验该物质。
(2)如果粗盐中SO42含量较高,必须添加钡试剂除去SO42,该试剂可以是_____________________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 d.BaCO3
(3)为有效除去Ca2+、Mg2+、SO42,加入试剂的合理顺序为__________________。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)醋酸的电离平衡常数表达式为:__________________________。
(2)a、b、c三点c(H+)由大到小的顺序是________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com