
| A. | 28gN2所含原子数为NA | B. | 0.5molH2O所含原子数为1.5NA | ||
| C. | 1molH2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算该题.
解答 解:A.n(N2)=$\frac{28g}{28g/mol}$=1moL,则含有2molN原子,数目为2NA,故A错误;
B.H2O为3原子分子,则0.5molH2O含有1.5mol原子,所含原子数为1.5NA,故B正确;
C.由n=$\frac{N}{{N}_{A}}$可知,1molH2O含有的水分子数目为NA,故C正确;
D.由n=$\frac{N}{{N}_{A}}$可知,0.5NACl2分子的物质的量是0.5mol,故D正确.
故选A.
点评 本题考查物质的量的有关计算,为高频考点,侧重考查学生的分析能力和计算能力,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
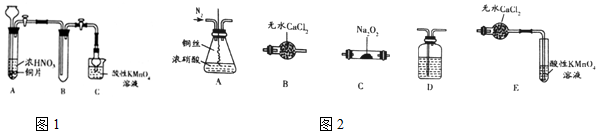
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
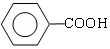
+
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 实验目的 | 解释 | |
| A | 图1 | 检验产物 | 错误,乙醇也能使高锰酸钾褪色 |
| B | 图2 | 配制银氨溶液 | 错误,只能制得沉淀 |
| C | 图3 | 比较醋酸、碳酸、苯酚酸性强弱 | 正确,可以发生预期现象 |
| D | 图4 | 制取乙酸乙酯并分离 | 正确,用氢氧化钠可以除去乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由乙醇生成乙烯的反应类型相同 | |
| B. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| C. | 硫酸铵和硝酸铅均能使蛋白质变性 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 沼气是可再生资源,电能是二次能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com