已知A、B、D、E、F五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子s轨道电子数是p轨道电子数的2倍;D原子中未成对电子数是同周期元素中最多的;E原子L层上有2对成对电子;F原子核外共有21个电子.
请回答下列问题:
(1)写出F元素基态原子的电子排布式为______.
F单质的晶体具有体心立方结构,则在该晶体的一个晶胞中,含有的原子数是______.
(2)B、D、E三种元素的第一电离能最大的是______(填元素符号),
(3)B与D原子结合形成的晶体目前是世界上最硬的材料,晶体结构类似金刚石,但硬度超过了金刚石,其原因是______.
该晶体中任一原子的配位数比E单质晶体中分子的配位数要______.
【答案】
分析:本题根据21元素,确定为钪元素,根据元素周期表推断其核外电子排布,体心立方晶体的结构及晶胞中原子数的计算方法;碳、氮、氧、第一电离能的判断;氮原子半径小于碳,氮碳形成的共价键键长比碳碳键更短,键能更大等知识点来解题.
解答:解:A原子所处的周期数、族序数都与其原子序数相等,故A为氢;B原子s轨道电子数是p轨道电子数的2倍,故B为碳元素;E原子L层上有2对成对电子,故E为氧;A、B、D、E、F五种元素的原子序数依次增大,D原子中未成对电子数是同周期元素中最多的,故D为N,三个单电子;F原子核外共有21个电子,故F为钪;
(1)F为21号元素,核外电子数为21,核外电子排布为1s
22s
22p
63s
23p
63d
14s
2; 体心立方即体心位置有一个钪原子,上下八个顶点各一个,单位晶胞原子数为1+8×

=2 个;
故答案为:1s
22s
22p
63s
23p
63d
14s
2; 2;
(2)B为C,D为N,E为O,一般来说,核外电子的最外层电子数越多,第一电离能越大,但是氮的p轨道为半充满结构,比较稳定,而氧失去一个电子后形成半充满结构,故氮的第一电离能大于氧的第一电离能,故N的第一电离能最大;
故答案为:N;
(3)B为C,D为N,氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大;氮碳晶体结构类似金刚石,故其原子的配位数为4,而固体氧晶体的结构有多种,配位数大于四,故氮碳晶体的配位数小于氧晶体.
故答案为:氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大;小;
点评:本题考查了元素钪的核外电子排布,体心立方晶胞,第一电离能大小比较,键能大小判断的依据等知识点.

 =2 个;
=2 个; 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 则:
则:


 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:

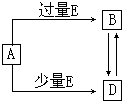 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).